
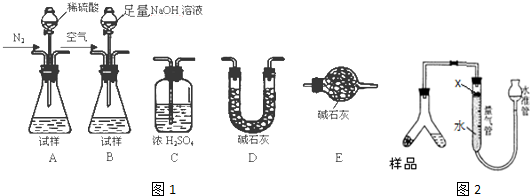
| 实验编号 药品 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
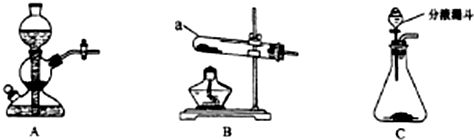
分析 (1)依据仪器的图形和作用分析a为试管;仪器安装是从下到上,从左到右;
(2)过氧化氢溶液和二氧化锰混合制取氧气是过氧化氢在二氧化锰催化作用下分解生成氧气和水;
(3)①实验室制取二氧化碳的反应为碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水;
②研究盐酸浓度大小对反应的影响,改变盐酸浓度和相同质量的块状固体碳酸钙反应,比较反应速率快慢;
③甲丙和乙丁可以研究固体接触面积大小对反应速率的影响;
④甲和丁对比,固体状态和盐酸溶液浓度不同,浓度越大反应速率越大,接触面积越大反应速率越大;
解答 解:(1)仪器a为试管;仪器安装是从下到上,从左到右,搭建B装置时,酒精灯应在固体仪器a之前放置,
故答案为:试管;前;
(2)过氧化氢溶液和二氧化锰混合制取氧气是过氧化氢在二氧化锰催化作用下分解生成氧气和水,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;
(3)①实验室制取二氧化碳的反应为碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,反应的化学方程式为:CaCO3+2HCl→CaCl2+H2O+CO2↑,
故答案为:CaCO3+2HCl→CaCl2+H2O+CO2↑;
②研究盐酸浓度大小对反应的影响,改变盐酸浓度和相同质量的块状固体碳酸钙反应,比较反应速率快慢,选择实验甲和乙对比分析反应速率可以得到浓度变化对反应速率的影响,浓度越大反应速率越大,
故答案为:乙;
③图表实验试剂的状态和盐酸溶液浓度分析可知,甲丙和乙丁可以研究固体接触面积大小对反应速率的影响,影响反应因素是固体反应物的颗粒大小(或反应物的接触面积),
故答案为:固体反应物的颗粒大小(或反应物的接触面积);
④甲和丁对比,固体状态和盐酸溶液浓度不同,浓度越大反应速率越大,接触面积越大反应速率越大,丁实验中固体和液体接触面积大,盐酸浓度大,所以反应速率大,
a.丁实验反应更为剧烈,故a正确;
b.丁反应剧烈,二氧化碳气体带出水蒸气越多,最终剩余溶液的质量更小,故b正确;
c.丁实验和甲中碳酸钙质量相同完全反应产生二氧化碳的质量相同,故c错误;
d.只是反应速率的不同,盐酸过量碳酸钙能全部反应,大理石利用率近似相同,故d错误;
故答案为:ab;
点评 本题考查了气体制备、浓度、接触面积对反应速率的影响实验验证分析判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 或
或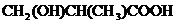 或
或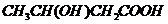 或
或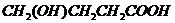


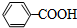
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | Na在Cl2中燃烧的生成物含离子键 | NaCl固体可导电 |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | 乙烯可与KMnO4溶液发生反应 | 乙烯具有还原性 |
| D | 乙醇的沸点比乙酸的沸点高 | 乙醇和乙酸可通过蒸馏初步分离 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 | |
| B. | 食醋的主要成分是醋酸,将一定量的醋酸溶液稀释,溶液中各离子的浓度都减小 | |
| C. | 味精的主要成分是谷氨酸钠,向其中加入盐酸可得谷氨酸,谷氨酸具有两性 | |
| D. | 木糖醇(C5H12O5)是一种甜味剂,它属于多羟基化合物,与葡萄糖互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com