
【题目】Ⅰ.饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质。A、B、C、D、E五种常见化合物都是由下表中的离子形成:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO42- HCO3- NO3- OH- |
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为____________。
(2)写出实验②发生反应的离子方程式: 。
(3)C常用作净水剂,用离子方程式表示其净水原理: 。
Ⅱ.某强酸性溶液X可能含有A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-中的若干种,取该溶液进行连续实验,实验过程及产物如下:
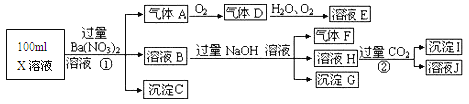
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子有_____________肯定不存在的离子是_________________
(2)请设计简单的实验检验不能确定是否含有的离子(若不止一种,可任选一种)的存在:____________________。
(3)写出反应①的离子方程式:________________。
(4)假设测定A、F、I均为0.1mol,100mL X溶液中n(H+)=0.4mol,当沉淀C的物质的量大于0.7mol时,溶液X中还一定含有____________.
【答案】
Ⅰ.(1)Na2CO3;
(2)Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O;
(3)Al3++3H2O![]() Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
Ⅱ.(1)Al3+、NH4+、Fe2+、SO42-;CO32-、SO32-
(2)取少量X溶液于试管中,加入几滴KSCN溶液,若溶液变红色则说明有Fe3+,反之则无Fe3+
(或取少量B溶液于试管中,加入几滴AgNO3溶液,若有白色沉淀则说明有Cl-,反之则无Cl-)
(或取少量X溶液于试管中,滴加Ba(NO3)2溶液至不再产生沉淀,再取上层清液于另一试管向其中滴加AgNO3溶液,若有白色沉淀则说明有Cl-,反之则无Cl-)
(3)3Fe2+ + 4H++ NO3—=3Fe3++NO↑+2H2O 、Ba2++SO42- =BaSO4↓;
(4)Fe3+
【解析】
试题分析:Ⅰ.①将它们溶于水后,D为蓝色溶液,其他均为无色溶液,则D中含有Cu2+离子;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解,则C中含有Al3+离子,E中含有OH-离子;
③进行焰色反应实验,只有B、C为紫色,则B、C含有K+离子,结合离子共存,所以E是NaOH;
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,则A中含有HCO3-离子,C、D中产生白色沉淀,则C、D中含有SO42-离子,所以D是CuSO4,C是KAl(SO4)2,A是NaHCO3;
⑤将B、D两溶液混合,未见沉淀或气体生成,则B是KNO3。
(1)A是NaHCO3,E是NaOH,1mol A的溶液与含1mol E的溶液反应生成碳酸钠和水,蒸干过程中碳酸钠水解得到碳酸氢钠与氢氧化钠,最终二者又反应得到Na2CO3,故答案为:Na2CO3 ;
(2)实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O;
(3)C中含有铝离子,铝离子易水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水 中的悬浮物而净水,水解反应方程式为:Al3++3H2O![]() Al(OH)3(胶体)+3H+,故答案为:Al3++3H2O
Al(OH)3(胶体)+3H+,故答案为:Al3++3H2O![]() Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
Ⅱ.(1)在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,一定不含有CO32-、SO32-;故答案为:Al3+、NH4+、Fe2+、SO42-;CO32-、SO32-;
(2)不能确定是否含有的离子Fe3+和Cl-,取少量X溶液放在试管中,加入几滴KSCN,溶液变红色说明有Fe3+,反之则无Fe3+; 或者取少量B溶液放在试管中,加入几滴AgNO3溶液,白色沉淀说明有Cl-,反之则无Cl-;故答案为:取少量X溶液放在试管中,加入几滴KSCN,溶液变红色说明有Fe3+,反之则无Fe3+; 或者取少量B溶液放在试管中,加入几滴AgNO3溶液,白色沉淀说明有Cl-,反之则无Cl-;
(3)Fe2+离子被氧化为Fe3+离子,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(4)A、F、I均为0.1mol,100mLX溶液中n(H+)=0.4mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知亚铁离子为0.3mol,根据溶液电中性可知:n(H+)+2n(Fe2+)+3n(Al3+)+n(NH4+)=2n(SO42-),n(SO42-)=![]() =0.7mol,当沉淀C物质的量>0.7mol时一定含有Fe3+离子,反之,含有Cl-离子,故答案为:Fe3+。
=0.7mol,当沉淀C物质的量>0.7mol时一定含有Fe3+离子,反之,含有Cl-离子,故答案为:Fe3+。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。I.在具支试管中加入碎瓷片和无水硫酸铝,用注射器吸取一定量石蜡油,重新连接好装置;点燃酒精灯,加热具支试管中的碎瓷片和无水硫酸铝的混合物约两分钟;将注射器中的石蜡油缓慢、逐次推入具支试管中,石蜡油与灼热的碎瓷片和无水硫酸铝接触,将所得气体依次通入酸性高锰酸钾溶液和溴水中,发现酸性高锰酸钾溶液和溴水均褪色.,将导气管迅速替换成燃烧尖嘴,点燃气体,火焰明亮,有黑烟。
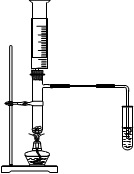
(1)碎瓷片和无水硫酸铝的作用是___________。
(2)通过本实验说明____________________。
II.实验室可用氯气与金属铁反应制备无水三氯化铁,三氯化铁呈棕红色、易潮解,100![]() 左右时升华。某化学兴趣小组利用下列实验装置制备并收集无水三氯化铁。
左右时升华。某化学兴趣小组利用下列实验装置制备并收集无水三氯化铁。
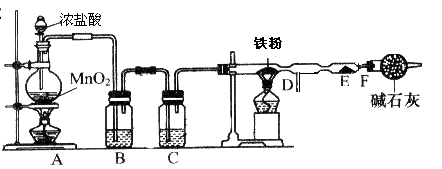
(3)A装置中发生反应的离子方程式为 ;
(4)实验时,先点燃A处的酒精灯,当D管处颜色变黄绿色时,再点燃D处的酒精灯,这样操作是为了 。
(5)B装置中应盛放的试剂名称为 ;
(6)F装置所起的作用是阻止空气中的水进入反应器,防止无水三氯化铁潮解和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用正确的序号填空: ①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3 ;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 断溶解 | C的质 量增加 | A上有气 体产生 |
根据实验现象回答下列问题:
①装置甲中作正极的是_____ ___ (填“A”或“B”)。
②装置乙溶液中Cu2+向_____ __极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于___ ___(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是____ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各粒子:①H3O+、NH4+、Na+;②OH-、NH2-、F-;③O2-、Na+、Mg2+;④CH4、NH3、H2O具有相同质子数和电子数的一组是
A. ①②③ B. ①②④ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH、KOH等碱性溶液可以贮存在下列哪种试剂瓶中()
A. 具有玻璃塞的细口瓶 B. 具有玻璃塞的广口瓶
C. 带滴管的滴瓶 D. 具有橡胶塞的细口瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体分子中的极性键在红外线的照射下,易像弹簧一样做伸缩和弯曲运动,从而产生热量而造成温室效应.下列不属于造成温室效应气体的是( )
A. CO2 B. N2O C. CH4 D. N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com