
【题目】(1)按如图所示操作,充分反应后:

①Ⅰ中发生反应的离子方程式为_____________________________________________;
②Ⅱ中铜丝上观察到的现象是________________________________________________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为______________________。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中还原产物是____________;若反应方程式中转移了0.3 mol电子,则氧化产物的质量是________g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,这个事实说明具有还原性的粒子还原性强弱为_________________________________________。
【答案】Fe+Cu2+===Fe2++Cu 红色铜丝上有银白色金属附着 Ag+>Cu2+>Fe2+ NO 4.8 Fe2+>Br->Cl-
【解析】
(1)铁与CuSO4溶液发生反应:Fe+Cu2+===Fe2++Cu,氧化性Cu2+>Fe2+,Cu与AgNO3溶液发生反应Cu+2Ag+===Cu2++2Ag,Ag附着在Cu的表面,氧化性Cu2+<Ag+,故氧化性Ag+>Cu2+>Fe2+。
(2)由于HNO3中的N为+5价,为氮元素的最高化合价,只具有氧化性,H2S中的S为-2价,只具有还原性,故此反应为HNO3+H2S→S↓+NO+H2O,还原产物为NO,氧化产物为S,由硫元素的化合价变化可知,当转移2 mol e-时生成32 g S,故转移0.3 mol e-时,得到S的质量为4.8 g。
(3)Fe2+、Br-均具有还原性,当通入少量Cl2时,只有Fe2+被氧化,说明还原性Fe2+>Br->Cl-。
(1)①Ⅰ中发生Fe与硫酸铜的置换反应生成Cu和硫酸亚铁,离子反应为Fe+Cu2+===Fe2++Cu,
故答案为:Fe+Cu2+===Fe2++Cu;
②Ⅱ中发生Cu与硝酸银的置换反应,该反应为Cu+2AgNO3=Cu(NO3)2+2Ag,观察到红色铜丝上有白色金属Ag附着,
故答案为:红色铜丝上有银白色金属附着;
③由两个反应可知,得到电子的物质为氧化剂,还原剂对应的产物为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,则氧化性为Ag+>Cu2+>Fe2+,
故答案为:Ag+>Cu2+>Fe2+;
(2)硝酸具有强氧化性,H2S具有较强还原性,二者发生氧化还原反应,故NO为还原产物、S为氧化产物,若反应过程中转移了0.3mol电子,由电子转移守恒,可知生成S的物质的量为:![]() =0.15mol,生成S的质量为:0.15mol×32g/mol=4.8g,
=0.15mol,生成S的质量为:0.15mol×32g/mol=4.8g,
故答案为:NO;4.8;
(3)一种氧化剂与多种还原剂反应时,先与还原性强的反应,将少量Cl2通入FeBr2的溶液中,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-,Fe2+被氧化,Br-没有被氧化,则还原性:Fe2+>Br-,还原剂的还原性大于还原产物的还原性,Fe2+>Cl-,
故答案为:Fe2+>Br->Cl-;


科目:高中化学 来源: 题型:
【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。己知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
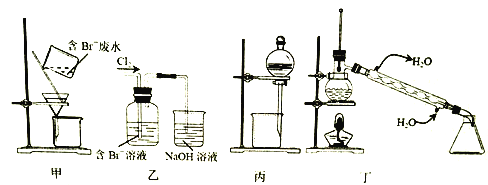
下列说法正确的是
A. 用甲装置过滤时,需不断搅拌
B. 丙装置中用正十二烷而不用CCl4,是因为其密度小
C. 用乙装置将Br-氧化为Br2
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,水的电离达到平衡:H2O![]() H++OH-。下列叙述正确的是( )
H++OH-。下列叙述正确的是( )
A. 向水中加入少量NH4Cl固体,平衡向正向移动,Kw变大
B. 向水中加入少量NaOH固体,平衡向正向移动,c(OH-)增大
C. 向水中加入少量固体硫酸氢钠,平衡向逆向移动,c(H+)增大
D. 向水中加入少量NaCl固体,平衡向正向移动,c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种重要的化工原料,请回答下列问题:
I.高铁酸钾(K2FeO4)溶液呈紫红色,向其中加入过量亚硝酸钠后,溶液紫红色逐渐褪去,并出现红褐色沉淀,请写出该反应的离子方程式__________。
II.实验室模拟下图所示流程制备亚硝酸钠:

已知:①氧化过程中,控制反应温度在35~60℃条件下主要发生反应:
C6H12O6+12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
②氢氧化钠溶液吸收NO和NO2发生反应:
NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O

(1)木屑的主要成分是纤维素,结合已知信息①,你认为向木屑中加稀硫酸的作用是______,氧化过程中反应温度不宜高于60℃,原因是______________。
(2)不做任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除了OH-外还有两种阴离子,其中一种是NO2-,NO2-与另一种阴离子的物质的量之比为________。
(3)装置B用于制备NaNO2,盛装的试剂除NaOH(aq)外,还可以是______(填字母)。
a.NaCl(aq) b.Na2CO3(aq) c.NaNO3(aq)
III.测定产品纯度:
【实验步骤】①准确称量ag产品配成200mL溶液;②从步骤①配制的溶液中移取20.00mL加入锥形瓶中;③用cmol/L酸性KMnO4溶液滴定至终点;④重复以上操作3次,消耗酸性KMnO4溶液的平均体积为VmL
(1)锥形瓶中发生反应的离子方程式为_____________。达到滴定终点的现象是_________。
(2)产品中NaNO2的纯度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 水的电离程度始终增大
B. ![]() 先增大再减小
先增大再减小
C. c(CH3COOH)与c(CH3COO-)之和始终保持不变
D. 当加入氨水的体积为10 mL时,c (NH4+)=c(CH3COO-)
【答案】D
【解析】试题分析:A、CH3COOH属于弱酸,抑制水的电离,加入NH3·H2O,消耗CH3COOH,水的电离程度增大,但氨水过量后,对水电离抑制,故错误;B、当向CH3COOH溶液中滴加相同浓度的NH3·H2O,开始时溶液为CH3COOH和CH3COONH4的混合物,由CH3COONH4的水解常数Kh=[c(H+)×c(NH3·H2O)]/c(NH4+),随着氨水的加入,c(H+)逐渐减小,Kh不变,因此c(NH4+)/c(NH3·H2O)变小,当氨水至溶液显碱性时,氨水的电离常数Kb=[c(OH-)×c(NH4+)]/c(NH3·H2O),随着氨水的加入,c(OH-)逐渐增大,Kb不变,c(NH4+)/c(NH3·H2O)变小,因此此比值始终变小;C、根据物料守恒,n(CH3COOH)+n(CH3COO-)=0.001mol,由于溶液体积逐渐增大,因此c(CH3COOH)和c(CH3COO-)之和逐渐减小,故错误;D、当加入氨水的体积为10mL,醋酸和NH3·H2O物质的量相等,由于二者电离常数相等,因此溶液显中性,c(H+)=c(OH-),根据电荷守恒,c(NH4+)=c(CH3COO-),故正确。
考点:考查电离平衡常数、水解平衡常数、离子浓度大小比较等知识。
【题型】单选题
【结束】
13
【题目】常温下,下列有关离子浓度及pH大小的比较,正确的是( )
A. NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序是:③>②>①
B. 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C. pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合后,混合溶液的pH>7
D. pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13<pH<14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40℃时,在氨—水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是( )
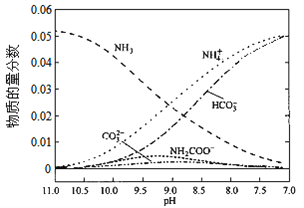
A. 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B. 不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
C. 在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
D. 随着CO2的通入,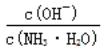 不断增大
不断增大
【答案】D
【解析】从图中在pH=9的点,做一条垂线就可以大致判断其浓度,所以有c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-),选项A正确。c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)是溶液的电荷守恒,所以是任何pH下都成立的。选项B正确。随着pH的降低,NH2COOˉ的浓度增大,说明生成了含有NH2COOˉ的化合物,后期NH2COOˉ的浓度又减小,说明该化合物又被反应,说明含有NH2COOˉ的化合物是中间产物,选项C正确。根据一水合氨的电离平衡常数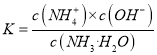 ,得到
,得到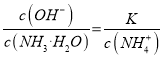 ,因为通入二氧化碳实际就是加入碳酸,加入酸c(NH4+)一定增大,所以
,因为通入二氧化碳实际就是加入碳酸,加入酸c(NH4+)一定增大,所以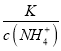 减小,即
减小,即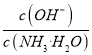 减小,选项D错误。
减小,选项D错误。
【题型】单选题
【结束】
17
【题目】下列物质中:A.KI(s) B.C2H5OH(l) C.Cl2(g) D.CH3COOH(l)E.BaSO4(s) F.NaHSO4(aq) G.石墨(s) H.蔗糖(s) I.NaOH(l) J.硫酸 K.盐酸
(1)属于非电解质的是____________(填序号,下同),属于强电解质的是____________,属于弱电解质的是____________。
(2)能直接导电的是________________,电解质中能溶于水,且水溶液能导电是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 铜溶于0.5mo/L的硝酸:Cu+4H++2NO3- =Cu2++2NO2↑+2H2O
B. Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
C. 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D. Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com