
分析 (1)依据摩尔质量的定义解答;
(2)根据n=$\frac{m}{M}$计算NaCl的物质的量,溶液中n(Cl-)=n(NaCl),根据c=$\frac{n}{V}$计算NaCl、Cl-的物质的量浓度;
(3)依据溶液稀释规律;稀释过程中溶质的物质的量不变解答;
(4)根据电荷守恒:c(H+)+c(Na+)=c(Cl-),据此计算c(H+);根据n=cV计算溶液中H+的物质的量,而氢离子源于HCl的电离,故n(HCl)=n(H+),再根据V=nVm计算HCl的体积;
(5)两等份溶液中一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知n(SO42-)=n(Ba2+),另一份加氢氧化钠溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)=$\frac{1}{2}$n(OH-),
再利用电荷守恒可知每份中2n(Mg2+)+n(K+)=2n(SO42-),据此计算每份中n(K+),根据c=$\frac{n}{V}$计算钾离子浓度.
解答 解:(1)物质的摩尔质量单位为g/mol时,在数值上等于其相对分子质量或相对原子质量;
故答案为:g/mol;相对分子质量;
(2)117g NaCl的物质的量=$\frac{117g}{58.5g/mol}$=2mol,溶于水配成1L溶液,故c(NaCl)=$\frac{2mol}{1L}$=2mol/L,溶液中n(Cl-)=n(NaCl)=2mol,故c(Cl-)=$\frac{2mol}{1L}$=2mol/L,
故答案为:2mol/L;2mol/L;
(3)设需要改溶液体积为V,则依据稀释过程中溶质的物质的量不变:2mol/L×V=1mol/L×500mL,解得V=250mL;
故答案为:250mL;
(4)根据电荷守恒:c(H+)+c(Na+)=c(Cl-),故c(H+)=3mol/L-2mol/L=1mol/L,而氢离子源于HCl的电离,故n(HCl)=n(H+)=1L×1mol/L=1mol,故V(HCl)=1mol×22.4L/mol=22.4L,
故答案为:1mol/L;22.4L;
(5)混合溶液分成两等份,每份溶液浓度与原溶液浓度相同,
一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知n(SO42-)=n(Ba2+)=n(BaCl2)=bmol,
另一份加氢氧化钠溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)=$\frac{1}{2}$n(OH-)=$\frac{1}{2}$amol,
由电荷守恒可知每份中2n(Mg2+)+n(K+)=2n(SO42-),故每份中溶液n(K+)=2b-2×$\frac{1}{2}$amol=(2b-a)mol,
则原混合溶液中钾离子的浓度为$\frac{\frac{(2b-a)mol}{V}}{2}$=$\frac{4b-2a}{V}$mol/L;
故答案为:$\frac{4b-2a}{V}$.
点评 本题考查了有关摩尔质量、物质的量浓度概念的理解及相关计算,题目难度不大,注意对公式的理解与灵活应用,注意电解质溶液中离子浓度计算常用电荷守恒规律解答.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④⑥ | C. | ②③⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | 氮 | Y | |
| X | 硫 | Z |
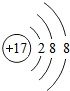 ;写出工业生产X单质粗产品的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO.
;写出工业生产X单质粗产品的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 蛋白质可以通过烧焦时的特殊气味进行鉴别 | |
| C. | 乙烯和聚乙烯分子中均含有碳碳双键 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在常温下就容易被氧化 | |
| B. | 钠在空气中燃烧生成Na2O | |
| C. | 钠与氧气化合时作还原剂 | |
| D. | 钠在自然界中只能以化合物的形式存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com