
【题目】硫元素在自然界中通常以硫化物、硫酸盐或单质的形式存在,其单质和化合物在工农业生产中有着重要的作用。
(1)硫元素在周期表中的位置为___________,其最简单气态氢化物的电子式为_________。
(2)在工业上SO2可以用于制备H2SO4。
已知SO2(g)+![]() O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
H2O(g)=H2O(l) △H2=-44kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H3=-130kJ·mol-1
则2SO2(g)+O2(g)=2SO3(g) △H=_____________kJ·mol-1
(3)某兴趣小组同学探究SO2的还原性,使用的药品和装置如图所示:

A瓶中发生反应的离子方程式为_______________________。B瓶中出现的现象为________。若要证明A、B的反应中SO2均显现还原性被氧化为SO42—,可以采取的操作和现象是_______________________________________。
(4)硫的氧化物排放到大气中会造成空气污染,常温常压下用如图所示传感器可以检测空气中SO2的含量。下列关于该传感器的叙述正确的是__________(填序号)。

A. a为电源的正极
B. Pt电极网上发生氧化反应
C.当电路中电子转移0.5mol时,进入传感器的SO2为11.2L
D.阴极的电极反应是2HSO3—+2H+-2e—=S2O42—+2H2O
【答案】第三周期第ⅥA族 ![]() -197 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 溶液蓝色褪去 取反应后A、B中的溶液加入盐酸酸化的BaCl2,产生白色沉淀 A
-197 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 溶液蓝色褪去 取反应后A、B中的溶液加入盐酸酸化的BaCl2,产生白色沉淀 A
【解析】
(1)硫在周期表中位于第三周期第ⅥA族;H2S是共价化合物,其电子式为![]() 。
。
(2)已知:①SO2(g)+![]() O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1,②H2O(g)=H2O(l) △H2=-44kJ·mol-1,③SO3(g)+H2O(l)=H2SO4(l) △H3=-130kJ·mol-1,由盖斯定律可知(①-②-③)×2得2SO2(g)+O2(g)=2SO3(g),则△H=(△H1-△H2-△H3)×2=[(-272.5kJ·mol-1)-(-44kJ·mol-1)-(-130kJ·mol-1)]×2=-197kJ/mol;
O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1,②H2O(g)=H2O(l) △H2=-44kJ·mol-1,③SO3(g)+H2O(l)=H2SO4(l) △H3=-130kJ·mol-1,由盖斯定律可知(①-②-③)×2得2SO2(g)+O2(g)=2SO3(g),则△H=(△H1-△H2-△H3)×2=[(-272.5kJ·mol-1)-(-44kJ·mol-1)-(-130kJ·mol-1)]×2=-197kJ/mol;
(3)SO2通入FeCl3溶液中,对应的离子方程式为2Fe3++SO2+2H2O=2Fe2++ SO![]() +4H+;含有淀粉的碘水本身呈蓝色,通入SO2后,I2可以将SO2氧化成为SO42-,I2被还原成为I-,溶液蓝色褪去;要检验SO2被氧化成SO42-,只要检验A、B中是否含SO42-即可,检验的方法为:取反应后A、B中的溶液加入盐酸酸化的BaCl2,产生白色沉淀。
+4H+;含有淀粉的碘水本身呈蓝色,通入SO2后,I2可以将SO2氧化成为SO42-,I2被还原成为I-,溶液蓝色褪去;要检验SO2被氧化成SO42-,只要检验A、B中是否含SO42-即可,检验的方法为:取反应后A、B中的溶液加入盐酸酸化的BaCl2,产生白色沉淀。
(4)在Pt电极网上HSO3-被还原成S2O42-,判断Pt网电极为阴极,应该与电源负极相连,则a为正极,A正确、B错误;当电路中电子转移0.5mol时,进入传感器的SO2为0.5mol,但为常温常压所以体积不等于11.2L,C错误;阴极的电极发生还原反应,阴极电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O,D错误;故答案为A。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】草酸(分子式为 H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、动 物和真菌体中。下列有关判断不正确的是
A.草酸的摩尔质量是 90 g/mol
B.草酸中碳元素的质量分数为 13.3%
C.1 mol 草酸中约含有 6.02×1023 个分子
D.1 mol 草酸在标准状况下的体积约为 22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75% ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为无色液体。反应生成的水均已略去。它们有如下图所示的关系。

(1)写出化学式:A___________B____________J_____________。
(2)反应③中每生成1molF,转移电子的数目为:___________。
(3)反应④的化学方程式为:________________________________________________。
(4)离子方程式分别为:反应②__________________________________________;
⑤__________________________________________________________。
(5)反应①中,每1.00gC与足量的F作用,恢复到25℃放出55.6kJ热量,写出反应①的热化学方程式__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是

A.b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.图中b、c、d三点溶液中水的电离程度最大的是c点
C.b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D.pH=7时,溶液中c(H+)+c(Na+)+c(NH![]() )=c(SO
)=c(SO![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠具有强氧化性,下列说法不正确的是( )
A.过氧化钠与二氧化硫反应时可生成硫酸钠
B.1mol过氧化钠中阴离子数目约为6.02×1023
C.Na2O2与CO2反应时,Na2O2是氧化剂,CO2是还原剂
D.将等物质的量的Na2O和Na2O2分别溶于等质量的足量水中所得溶液的质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列反应:
①Fe+CuSO4=Cu+FeSO4
②CaO+H2O=Ca(OH)2
③Ba(OH)2+H2SO4 =BaSO4↓+2H2O
④Zn+2HCl=ZnCl2+H2↑
⑤2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
⑥CaCO3![]() CaO+CO2↑
CaO+CO2↑
⑦2CO+O2![]() 2CO2
2CO2
⑧SO42-+Ba2+=BaSO4↓
(1)反应①中,氧化剂是______________________。
(2)反应③的离子反应方程式为_________________________________________。
(3)写出一个符合⑧的化学反应方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2 + NH3 + H2O + NaCl = NaHCO3↓+ NH4Cl的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:

则下列叙述错误的是( )
A.A气体是NH3,B气体是CO2
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组想制取CuO并证明CuO能加快KClO3的分解速率,设计并进行如下实验:
(一)制取CuO
①称取2 g胆矾研细后放入烧杯,加适量蒸馏水溶解;
②向步骤①所得溶液中逐滴加入NaOH溶液至铜离子沉淀完全;
③将步骤②所得沉淀过滤、洗涤,灼烧至恒重,研细备用。
回答下列问题:
(1)上述实验步骤中溶解、过滤时玻璃棒的作用依次是_____________。
(2)步骤③中灼烧前后,沉淀颜色的变化为_______。
(3)利用化学方法证明铜离子已经沉淀完全的操作是____________。
(二)证明CuO能加快KClO3的分解速率,并与MnO2的催化效率进行比较
用下图装置进行实验,且均以生成相同状况下20 mL氧气为准,其它可能影响实验的因素均已忽略,相关数据见下表:

实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
① | 1.5 g | 无其他物质 | |
② | 1.5 g | CuO 0.5 g | |
③ | 1.5 g | MnO2 0.5 g |
(4)上述实验中的待测数据指_____________;该实验除以上思路外,还可以通过测定______________来比较CuO和MnO2的催化效率。
(5)本实验装置图中量气装置由乳胶管和仪器A_______________(填名称)及50 mL___________(填“酸式”或“碱式”)滴定管改造后组装而成;
(6)为探究CuO在实验②中是否起催化作用,需补做如下实验:
a.CuO的质量有没有改变;
b.CuO的化学性质有没有改变。
简述验证CuO质量是否改变的操作过程_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列关于该有机物的性质说法错误的是( )
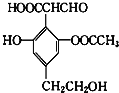
A. 1mol该物质可与4mol氢氧化钠溶液反应
B. 与NaHCO3溶液反应可以产生CO2气体
C. 该物质与H2反应,1mol该物质最多消耗3mol H2
D. 该物质可以使酸性KMnO4溶液褪色,也可发生消去反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com