
【题目】在一定温度下,容积为2L的密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示。
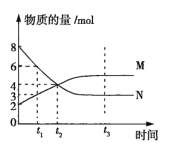
(1)该反应的化学方程式为___。
(2)比较t2、t3时正、逆反应速率的大小(用v正、v逆表示):t2时__;t3时__。
(3)若t2=2min,则反应开始至t2时,M的平均反应速率为__。
(4)下列说法可以表明该反应已达到平衡状态的是__(填序号)。
A.混合气体的密度不变
B.正、逆反应速率都等于零
C.M、N的物质的量浓度不变
D.M、N的物质的量浓度相等
(5)t3时化学反应达到平衡状态,请写出3个可以提高此时该反应化学反应速率的方法:__。
【答案】![]() v正>v逆 v正=v逆 0.5mol·L-1·min-1 C 升温、使用催化剂、提高反应物浓度
v正>v逆 v正=v逆 0.5mol·L-1·min-1 C 升温、使用催化剂、提高反应物浓度
【解析】
(1)反应过程中N的浓度在减小,M的浓度在增大,所以N是反应物,M是生成物。t2时,N减少了4mol,M增加了2mol,说明M和N的计量数之比=2:1,t3时,M、N的物质的量不再改变,说明该反应是可逆反应,已达到平衡,故该反应的化学方程式是![]() ,故答案为:
,故答案为:![]() ;
;
(2)t2时,反应没有达到平衡,反应正向进行,v正>v逆,t3时,M、N的物质的量不再改变,反应达到平衡,v正=v逆,故答案为:v正>v逆;v正=v逆;
(3)从反应开始到t2时, ,故答案为:0.5mol·L-1·min-1;
,故答案为:0.5mol·L-1·min-1;
(4)A.该反应中气体的总质量始终不变,总体积始终不变,所以密度始终保持不变,不能说明是否平衡,A错误;
B.平衡时,正、逆反应速率相等但是不等于0,B错误;
C.体积始终是2L,M、N的物质的量浓度不变,说明M、N的物质的量不再改变,说明已平衡,C正确;
D.M、N的物质的量浓度相等不代表M、N的物质的量不变,不能说明是否平衡,D错误;
故答案为:C;
(5)加快反应速率的方法有很多,比如:升温、使用催化剂、提高反应物浓度等,故答案为:升温、使用催化剂、提高反应物浓度。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 离子中的两种组成,可以发生如图转化,下列说法不正确的是
离子中的两种组成,可以发生如图转化,下列说法不正确的是![]()
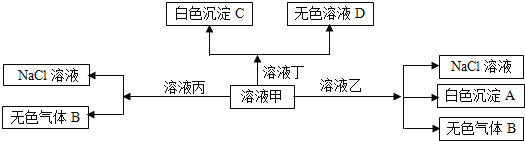
A.在甲中滴加丁可能发生反应:![]()
B.溶液丙中还可以大量共存的离子有:![]() 、
、![]() 、
、![]()
C.白色沉淀A可能溶解在溶液D中
D.甲为![]() ,乙为
,乙为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况,离子可能大量共存的是( )
A.Al3+、Na+、Cl-、CO32-
B.25℃,水电离出的OH-浓度为10-11mol/L的溶液中:K+、Na+、SO32-、NO3-
C.![]() =10-2溶液中:Cu2+、Na+、Cl-、NO3-
=10-2溶液中:Cu2+、Na+、Cl-、NO3-
D.无色溶液中:H+、Fe2+、Cl-、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型可逆电池的工作原理如下图所示。放电时总反应为:Al+3Cn(AlCl4)+4AlCl4-![]() 4Al2Cl7-+3Cn(Cn表示石墨)。
4Al2Cl7-+3Cn(Cn表示石墨)。

下列说法正确的是
A. 放电时负极反应为:2Al-6e-+7Cl-= Al2Cl7-
B. 放电时AlCl4-移向正极
C. 充电时阳极反应为: AlCl4-e-+Cn=Cn(AlCl4)
D. 电路中每转移3mol电子,最多有1molCn(AlCl4)被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )
A. 它的系统名称是2,4-二甲基-4-戊烯
B. 它的分子中至少有5个碳原子在同一平面上
C. 它与甲基环己烷(![]() )互为同分异构体
)互为同分异构体
D. 该有机物与氢气完全加成后的产物的一氯取代产物共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数,下列叙述正确的是( )
表示阿伏加德罗常数,下列叙述正确的是( )
A.3molFe在过量的纯氧中完全燃烧,转移的电子数为![]()
B.52g苯乙烯中含有的碳碳双键数目为![]()
C.标准状况下,![]() 和
和![]() 的混合气体的分子数目为
的混合气体的分子数目为![]()
D.![]() 溶液中
溶液中![]() 和
和![]() 的总数为
的总数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害。某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示。下列判断正确的是
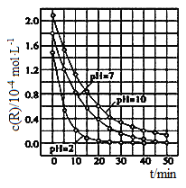
A. 在0~20min之间,pH=7时R的降解速率为0.07mol·L-1·min-1
B. R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响
C. 二氧化钛对pH=2的R溶液催化效率好
D. 在0~50 min之间,R的降解百分率pH=2大于pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式为________________。
②NO![]() 的空间构型__________(用文字描述)。
的空间构型__________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①CO分子的等电子体有______。(至少写两个)
②HCHO分子中C原子轨道的杂化类型为______。
③1 mol CO2中含有的σ键与π键数目之比为_____。
④CO还能以配体形式与金属形成配合物,如Fe(CO)5,1mol Fe(CO)5中π键数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
实验1 | 实验2 |
|
|
①、③中溶液呈蓝色,试管口有红棕色气体产生 | ③中溶液呈蓝色,试管口有红棕色气体产生 |
下列说法正确的是
A. 稀硝酸一定被还原为NO2
B. 实验1-②中溶液存在:c(Cu2+) + c(H+) =c(NO3-) + c(OH-)
C. 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D. 实验1-③、实验2-③中反应的离子方程式:3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com