
| A、晶体硅>金刚石>碳化硅 |
| B、CsCl>KCl>NaCl |
| C、SiO2>CO2>He |
| D、I2>Br2>Fe |


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物都属于分散系 |
| B、稀豆浆中分散质粒子的直径在1-100nm |
| C、FeCl3溶液中分散质的粒子为FeCl3 |
| D、含有1 mol FeCl3的饱和溶液加入到沸水中生成1 molFe(OH)3胶粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
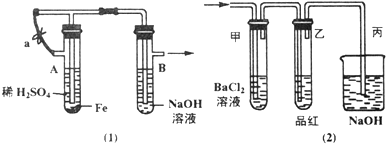
查看答案和解析>>
科目:高中化学 来源: 题型:
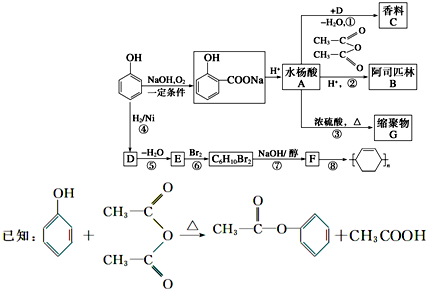
查看答案和解析>>
科目:高中化学 来源: 题型:
 次硫酸氢钠甲醛(NaHSO2?HCHO?2H2O)在印染、医药以及原子能工业中应用广泛,已知次硫酸氢钠甲醛具有强还原性,且在120℃以上发生分解.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
次硫酸氢钠甲醛(NaHSO2?HCHO?2H2O)在印染、医药以及原子能工业中应用广泛,已知次硫酸氢钠甲醛具有强还原性,且在120℃以上发生分解.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 理由 | 结论 |
| A | 与盐酸反应时,相同物质的量的原子失去电子的数目:Al>Na | 还原性:Al>Na |
| B | 室温时,相同物质的量浓度溶液的pH:AlCl3<MgCl2 | 碱性:Mg(OH)2>Al(OH)3 |
| C | 相同数目的分子可电离的H+数:H2SO4>HClO4 | 酸性:H2SO4>HClO4 |
| D | 用饱和NaHCO3溶液可以除去CO2 中含有的少量SO2 | 非金属性:S>C |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com