
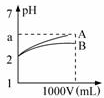
 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )| A. | a=5时,A是强酸,B是弱酸 | |
| B. | 若A、B都是强酸,则5>a>2 | |
| C. | 稀释后,A酸溶液的酸性比B酸溶液强 | |
| D. | A、B两种酸溶液的物质的量浓度一定相等 |
分析 由图可知,稀释相同的倍数,A的变化大,则A的酸性比B的酸性强,溶液中氢离子浓度越大,酸性越强,对于一元强酸来说c(酸)=c(H+),但对于一元弱酸,c(酸)>c(H+),以此来解答.
解答 解:A.由图可知,若a=5,A完全电离,则A是强酸,B的pH变化小,则B为弱酸,故A正确;
B.若A、B都是强酸,则稀释后溶液的pH都是5,与图象曲线变化不相符,故B错误;
C.由图可知,B的pH小,c(H+)大,则B酸的酸性强,故C错误;
D.因A、B酸的强弱不同,一元强酸来说c(酸)=c(H+),对于一元弱酸,c(酸)>c(H+),则A、B两种酸溶液的物质的量浓度不一定相等,故D错误;
故选A.
点评 本题考查酸的稀释及图象,题目难度中等,侧重于学生的分析能力的考查,明确强酸在稀释时pH变化程度大及酸的浓度与氢离子的浓度的关系是解答本题的关键.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | 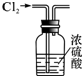 干燥Cl2 | B. | 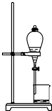 分离汽油与食盐溶液 | ||
| C. | 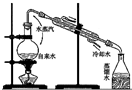 实验室制取少量蒸馏水 | D. | 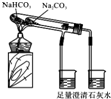 比较Na2CO3与NaHCO3的稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸的物质的量浓度是0.5mol•L-1 | B. | 氢氧化钠溶液的体积是250mL | ||
| C. | 铁和硅的物质的量之比为2:1 | D. | 铁和硅的质量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | w.9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | w0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
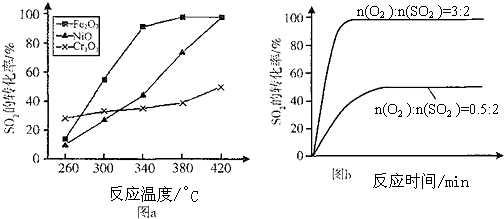
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,不可制得Fe(OH)3胶体 | |
| B. | 胶体与其他分散系的本质区别是胶体能发生丁达尔效应 | |
| C. | 用半透膜分离淀粉和食盐的混合液 | |
| D. | Fe(OH)3胶体逐渐加入稀硫酸,会产生沉淀而后溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 mol CCl4的体积约为22.4L | |
| B. | NaOH的摩尔质量是40g | |
| C. | 常温常压下,11.2L氧气与足量铜粉充分反应,转移的电子数为2NA | |
| D. | 46g NO2 和46g N2O4 含有的原子数均为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com