
 下列有关实验原理或实验操作正确的是
下列有关实验原理或实验操作正确的是
A.用干燥pH试纸测定某新制氯水的pH
B. 用酒精萃取碘水中的碘
C.用如图装置能除去乙烷中混有的乙烯
D.用25 mL碱式滴定管量取20.00 mLKMnO4 溶液
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,1.12 L CCl4含有C—Cl键数目为0.2NA
B.标准状况下,2.24 L氯气中含有的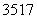 Cl数目一定为0.2NA
Cl数目一定为0.2NA
C.常温常压下,4.4 g CO2与N2O混合气体中含有的原子总数为0.3NA
D.80 mL 10 mol·L-1盐酸与足量MnO2加热反应,产生Cl2分子数小于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,现有A、B、C、D四种电解质分别完全溶于水,所得四种溶液中含H+、Ba2+、Al3+、Na+、HCO 、Cl-、OH-、SO
、Cl-、OH-、SO 八种离子(不考虑水解)。为了检验这四种物质,进行如下实验:
八种离子(不考虑水解)。为了检验这四种物质,进行如下实验:
①取少量A的溶液分别与另三种物质反应,依次观察到:白色沉淀和气体、气体、白色沉淀。
②经测定,A和D的溶液显碱性,B和C的溶液pH<7。B与D的溶液反应产生两种沉淀,当D的量增大时,其中一种沉淀不断溶解,最终还存在一种沉淀。
③C与D的溶液反应,无明显现象。经测定,该反应的产物总能量小于反应物总能量。
根据上述实验事实,请回答下列问题:
(1)C的名称是________。用离子方程式表示A的溶液显碱性的原因:_______________________________________________________________________________________________________________________。
(2)A与B在溶液中反应的离子方程式为________________________________ _________________________________________________________________。
(3)B的溶液中离子浓度大小顺序为___________________________________。
(4)等物质的量浓度、等体积的B和D的溶液混合,写出反应的离子方程式:____________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知浓H2SO4和Fe3+都可以将Cu氧化成Cu2+,浓H2SO4也可以将Br-氧化成Br2,Fe与Br2反应生成FeBr3.由此可以确定上述有关物质氧化性由强到弱的顺序为( )
A.浓H2SO4>Br2>Fe3+>Cu2+ B.浓H2SO4>Cu2+>Fe3+>Br2
C.Br2>浓H2SO4>Fe3+>Cu2+ D.Fe3+>Cu2+>Br2>浓H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学在生活中应用的说法,正确的是
A.绿色食品是不含任何化学物质的食品
B.明矾净水过程利用了胶体的性质
C.医疗上使用的“钡餐”化学成份是BaCO3
D.纯碱和小苏打都可用于制发酵粉,它们分别属于碱和盐
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色透明的溶液,在pH=2的条件下能大量共存的是
A.Fe3+、K+、SO42—、NO3— B.K+、Na+、AlO2—、Cl—
C.NH4+、K+、SO42-、Br—、 D.K+、Na+、NO3—、I—
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表格中的各种情况,可以用右图的曲线表示的是
| 反 应 | 纵坐标 | 甲 | 乙 | |
| A | 相同质量的氨,在同一容器中 2NH3 | 氨气的转化率 | 500℃ | 400℃ |
| B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| C | 在体积可变的恒压容器中,体积比1︰3的N2、H2, N2 + 3H2 | 氨气的浓度 | 活性高的 催化剂 | 活性一般的催化剂 |
| D | 2 molSO2和1 molO2,在相同温度下2SO2+ O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各种金属防护的方法中:①金属表面涂抹油漆 ②改变金属内部结构 ③保持金属表面清洁干燥 ④在金属表面进行电镀 ⑤使金属表面形成致密的氧化物薄膜,能对金属起到防止或减缓腐蚀作用的是 ( )。
A.①②③④ B.①③④⑤
C.①②④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)电子表和电子计算器中所用的是纽扣式微型银锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,工作时电池总反应为Ag2O+Zn+H2O===2Ag+Zn(OH)2。
①工作时电流从________极流向________极(填“Ag2O”或“Zn”)。
②电极反应式:正极______________________________,
负极:_____________________________________________。
③工作时电池正极区的pH________(填“增大”“减小”或“不变”)。
(2)氢镍电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是 H2+NiO(OH)
H2+NiO(OH)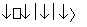 Ni(OH)2。
Ni(OH)2。
电池放电时,负极是________,负极的电极反应式为________,正极的电极反应式为____________________,正极附近溶液的pH如何变化?________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com