
| A. | 配制10%的ZnSO4溶液,将l0gZnSO4溶解于90g水中 | |
| B. | 用四氯化碳萃取碘水中的碘时,将碘的四氯化碳溶液从分液漏斗下口放出 | |
| C. | NaCl溶液蒸发结晶时,蒸发血中有晶体析出并剩余少量液体时即停止加热 | |
| D. | 检验蔗糖水解产物具有还原性时,先向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热 |
分析 A.将l0gZnSO4溶解于90g水中,溶液的质量分数为10%;
B.四氯化碳密度比水大;
C.蒸发时,应防止温度过高而导致固体迸溅;
D.检验蔗糖的水解产物,应在碱性条件下进行.
解答 解:A.将l0gZnSO4溶解于90g水中,溶液的质量分数为$\frac{10}{10+90}×100%$=10%,故A正确;
B.四氯化碳密度比水大,分液时下层液体从下口放出,故B正确;
C.蒸发时,有晶体析出并剩余少量液体时即停止加热,可防止温度过高而导致固体迸溅,故C正确;
D.蔗糖水解生成葡萄糖,检验葡萄糖,应在碱性条件下进行,故D错误.
故选D.
点评 本题考查较为综合,涉及溶液的配制、混合物分离提纯以及物质的检验,为高频考点,把握物质的性质、性质差异及发生的反应、混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷和乙烯都可以使溴水褪色 | |
| B. | 乙醇和乙酸都存在碳氧双键 | |
| C. | 高锰酸钾酸性溶液不可以氧化苯和甲烷 | |
| D. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
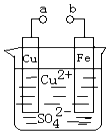
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Fe-3e-═Fe3+ | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 | |
| D. | a和b用导线连接后,铁片上发生还原反应,溶液中铜离子向铜电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
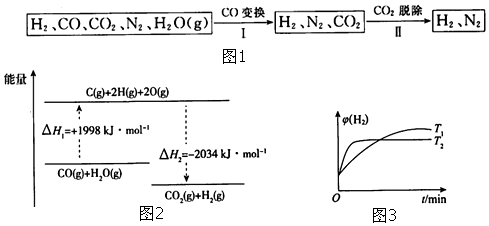
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:阴离子>阳离子 | B. | 酸性:HClO4>H2SO4 | ||
| C. | 熔沸点:共价化合物>离子化合物 | D. | 稳定性:PH3>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
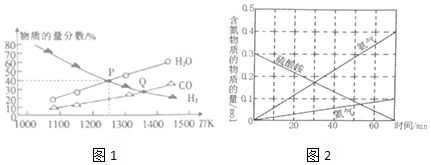
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
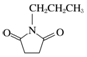 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com