
下列相关反应的离子方程式书写错误的是
A.Cl2与FeSO4溶液反应:
Cl2+2Fe2+===2Cl-+2Fe3+
B.等体积、等物质的量浓度的Ca(HCO3)2溶液和NaOH溶液混合:
Ca2++HCO +OH-===CaCO3↓+H2O
+OH-===CaCO3↓+H2O
C.用稀硫酸酸化的KMnO4溶液与少量H2O2反应:2MnO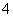 +6H++5H2O2===2Mn2++5O2↑+8H2O
+6H++5H2O2===2Mn2++5O2↑+8H2O
D.SO2通入NaClO溶液中:
SO2+ClO-+OH-===SO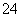 +Cl-+H+
+Cl-+H+
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
下列反应属于油脂硬化的是( )
A.油酸甘油酯与氢气的加成反应
B.油酸甘油酯在碱性条件下水解
C.油酸甘油酯在酸性条件下水解
D.油酸甘油酯与溴水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是
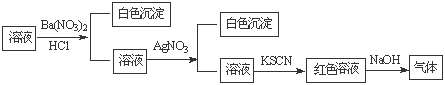
A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中存在如下反应:2A(g)+B(g)  3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

A.图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响
B.图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
D.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理其对环境的污染是当前环保工作的重要研究内容之 一。
一。
(1)一定条件下,发生反应2SO2(g)+O2(g)  2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g)和0.2 mol SO3(g),2 min后反应达到平衡时,测得SO2的物质的量为1 mol,若往容器中再加入2 mol SO2(g),则重新达到平衡时SO2的总转化率________50%(填“>”、“<”或“=”)。
2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g)和0.2 mol SO3(g),2 min后反应达到平衡时,测得SO2的物质的量为1 mol,若往容器中再加入2 mol SO2(g),则重新达到平衡时SO2的总转化率________50%(填“>”、“<”或“=”)。
(2)在一密闭容器中发生反应 2 NO2 2NO+O2
2NO+O2
ΔH>0,反应过程中NO2的浓度随时间变化的情况如下图所示。
请回答: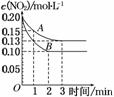 ①依曲线A,反应在前3 min内氧气的平均反
①依曲线A,反应在前3 min内氧气的平均反 应速率为________。
应速率为________。
②若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件可能是____ ____(填“浓度”、“压强”、“温度”或“催化剂”)。
____(填“浓度”、“压强”、“温度”或“催化剂”)。
(3)一定温度下,在密闭容器中N2O5可发生下列反应:
①2N2O5(g)  4NO2(g)+O2(g)
4NO2(g)+O2(g)
②2NO2(g)  2NO(g)+O2(g)
2NO(g)+O2(g)
若达平衡时,c(NO2)=0.4 mol/L,c(O2)=1.3 mol/L,则反应②中NO2的转化率为________,N2O5(g)的起始浓度应不低于________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是
A.用KIO3氧化酸性溶液中的KI:
5I-+IO +3H2O===3I2+6OH-
+3H2O===3I2+6OH-
B.向NH4HSO3溶液中加过量的NaOH溶液并加热:
NH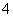 +OH-
+OH-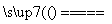 NH3↑+H2O
NH3↑+H2O
C.将过量SO2通入冷氨水中:
SO2+NH3·H2O===HSO +NH
+NH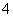
D.用稀盐酸洗涤试管内壁的银镜:
2Ag+2H++2Cl-===2AgCl↓+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式表达正确的是
A.用惰性电极电解熔融氯化钠:
2Cl-+2H2O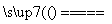 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.用氢氧化钠溶液除去铝表面的氧化膜:
Al2O3+2OH-===2AlO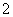 +H2O
+H2O
C.用稀氢氧化钠溶液吸收二氧化氮:
2OH-+2NO2===NO +NO↑+H2O
+NO↑+H2O
D.用食醋除去水瓶中的水垢:
CO +2CH3COOH===2CH3COO-+CO2↑+H2O
+2CH3COOH===2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对聚氯乙烯树脂的用途叙述中,不正确的是( )
A.该树脂加入一定的添加剂后,可以用来制造农用薄膜
B.该树脂加入一定的添加剂后,可以用来制造管材
C.该树脂加入一定的添加剂后,可以用来制造有机玻璃
D.该树脂加入一定的添加剂后,可以用来制造化学纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的离子不含电子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)E元素在元素周期表中的位置是 。
(2)由A、B、C三种元素形成的离子化合物的化学式为 。
(3)A、C、E间可形成甲、乙两种三原子分子,且甲有18个电子、乙有10个电子,甲与乙比较,沸点较高的是(填化学式) 。
(4)F含有的化学键类型是 和 ,其水溶液呈酸性,请用相关的离子方程式解释其原因 。
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com