
0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为______________________________________。
又已知:H2O(l)===H2O(g) ΔH=44 kJ·mol-1。则11.2 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是__________kJ。
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是(双选)( )
A.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH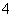
B.将Fe(OH)2溶于过量的稀硝酸:Fe(OH)2+2H+===Fe2++2H2O
C.用NaClO溶液吸收过量的SO2:ClO-+SO2+H2O===SO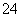 +Cl-+2H+
+Cl-+2H+
D.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.破坏反应产物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应
C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的计量系数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
(1)H2(g)+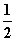 O2(g)===H2O(g) ΔH1=a kJ·mol-1
O2(g)===H2O(g) ΔH1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ·mol-1
(3)H2(g)+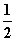 O2(g)===H2O(l) ΔH3=c kJ·mol-1
O2(g)===H2O(l) ΔH3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l) ΔH4=d kJ·mol-1
下列关系式中正确的是( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH
 CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1HCl溶液,溶液中[H+]减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
将1 mol冰醋酸加入到一定量的蒸馏水中最终得到1 L溶液。下列各项中,表征已达到电离平衡状态的是( )
A.醋酸的浓度达到1 mol·L-1
B.[H+]的浓度达到0.5 mol·L-1
C.[CH3COOH]、[CH3COO-]、[H+]均为0.5 mol·L-1
D.醋酸分子电离成离子的速率和离子重新结合成分子的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为:该溶液pH升高的原因是HCO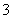 的水解程度增大,碱性增强。
的水解程度增大,碱性增强。
乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3的水解程度(填“大于”或“小于”)。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液 C. NaOH溶液 D.澄清石灰水
(2)将加热煮沸后的溶液冷却到10 ℃,若溶液的pH________8.3(填“高于”、“低于”或“等于”),则甲判断正确。
(3)查阅资料,发现NaHCO3固体的分解温度为150 ℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是_______________________________________________________________。
(4)关于NaHCO3饱和水溶液的表述正确的是_______________________。
a.c(Na+)=c(HCO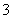 )+c(CO
)+c(CO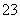 )+c(H2CO3)
)+c(H2CO3)
b.c(Na+)+c(H+)=c(HCO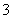 )+c(CO
)+c(CO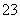 )+c(OH-)
)+c(OH-)
c.HCO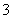 的电离程度大于HCO
的电离程度大于HCO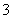 的水解程度
的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应有广泛应用。
(1)我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为S+2KNO3+3C===K2S+3CO2↑+N2↑。
上述反应中,如1.5 mol还原剂________(填“得到”或“失去”)________ mol电子,则生成________ g还原产物。
(2)铝热法是常用的金属冶炼方法之一。
已知:4Al(s)+3O2(g)===2Al2O3(s)
ΔH1=-3 352 kJ·mol-1
Mn(s)+O2(g)===MnO2(s) ΔH2=-521 kJ·mol-1
Al与MnO2反应冶炼金属Mn的热化学方程式是________________。
(3)高温电解技术能高效实现CO2(g)+H2O(g)===CO(g)+H2(g)+O2(g),工作原理示意图如下:
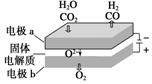
①电极b发生________(填“氧化”或“还原”)反应;
②CO2在电极a放电的反应式是__________________。
(4)黑色沉淀CuS、Cu2S放入浓硫酸中加热一段时间后,沉淀完全溶解,其中CuS溶解的化学方程式是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com