
| A. | 过氧化钠 | B. | 氯水 | C. | 过氧化钙 | D. | 双氧水 |
分析 过氧化钠虽能制取氧气,但生成的氢氧化钠为强碱,碱性太强;氯气和水反应生成氯化氢和次氯酸,虽能杀菌,但生成物酸性太强,且不生成氧气,不吸收二氧化碳;过氧化钙与水反应有氧气生成,且生成的氢氧化钙在水中的溶解性较弱,且过氧化钙可以同时消耗二氧化碳;而双氧水虽能制取氧气,但不能消耗二氧化碳.
解答 解:A.过氧化钠虽能制取氧气和吸收二氧化碳,但生成的物质碱性太强,故A错误;
B.氯气和水反应生成氯化氢和次氯酸,虽能杀菌,但生成物酸性太强,且不生成氧气,不吸收二氧化碳,故B错误;
C.因为过氧化钙与水反应有氧气生成,且生成的氢氧化钙在水中的溶解性较弱,相应腐蚀性也小;且过氧化钙可以同时消耗二氧化碳,可维持氧气和二氧化碳的平衡,故C正确;
D.双氧水虽能制取氧气,但不能消耗二氧化碳,故D错误.
故选C.
点评 本题综合考查元素化合物知识,为高频考点,侧重于化学与生活实际相联系,要学会通过实验情景分析问题和解决问题,提高自己的解题能力.


科目:高中化学 来源: 题型:选择题
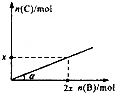 某容积可变的密闭容器中盛有足量的A,通人气体B,发生反应:A(s)+3B(g)?2C(g)+D(g);△H<0,在一定温度和压强下达到平衡.若平衡时C的物质的量与加入B的物质的量的变化关系如图所示.则下列说法中正确的是( )
某容积可变的密闭容器中盛有足量的A,通人气体B,发生反应:A(s)+3B(g)?2C(g)+D(g);△H<0,在一定温度和压强下达到平衡.若平衡时C的物质的量与加入B的物质的量的变化关系如图所示.则下列说法中正确的是( )| A. | 若保持压强不变,降低温度时,图中角度a将变小 | |
| B. | 若增大压强,缩小容器的体积,平衡向正反应方向移动 | |
| C. | 若保持压强不变,再通入B,则再次达到平衡时正、逆反应速率均增大 | |
| D. | 平衡时B、C的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量就是指物质的多少 | |
| B. | 物质的量和摩尔是两个不同的物理量 | |
| C. | 物质的量为1mol的物质含有约6.02×1023个粒子 | |
| D. | 1mol SO2和1mol SO3的质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液 | B. | 氢氧化钡溶液 | C. | 氨水溶液 | D. | 澄清的石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、CO2、SO2、O2 | B. | CO2、SO2、Cl2、O2 | C. | CO2、Cl2、O2、SO2 | D. | HCl、SO2、CO2、O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 •
•查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com