
| n |
| V |
| 消耗量 |
| 起始量 |
| △c |
| △t |
| n |
| V |
| 1.6mol |
| 2L |
| 消耗量 |
| 起始量 |
| 1.2mol |
| 2mol |
| △c |
| △t |
| ||
| 2min |


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
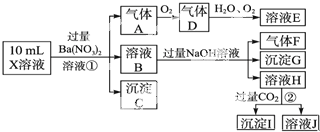
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
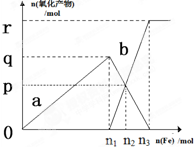 含有4.0mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(还原产物只有NO).下列有关判断正确的是( )
含有4.0mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(还原产物只有NO).下列有关判断正确的是( )| A、a是Fe(NO3)2 |
| B、n1=0.80 |
| C、p=0.60 |
| D、n3=1.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com