
分析 相同条件下体积比等于物质的量之比,根据体积分数可知物质的分数,结合n=$\frac{m}{M}$,ρ=$\frac{M}{{V}_{m}}$计算相关物理量.
解答 解:相同条件下体积比等于物质的量之比,空气中N2体积分数为78%,O2体积分数为21%,假设其余都为CO2,可知空气中N2物质的量分数为78%,O2物质的量分数为21%,CO2的物质的量分数1%,
设气体为1mol,则N2为0.78mol,O2为0.21mol,CO2为0.01mol,则1mol气体的总质量为0.78mol×28g/mol+0.21mol×32g/mol+0.01mol×44g/mol=29g,
所以空气的平均摩尔质量为29g/mol,
密度为$\frac{29g/mol}{22.4L/mol}$=1.29g/L
答:空气的平均摩尔质量为29g/mol,标准状况下的密度为1.29g/L.
点评 本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的应用以及物质的构成,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、PH3、AsH3 | B. | SiH4、PH3、H2S | C. | HI、HBr、HCl | D. | H2S、HCl、AsH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
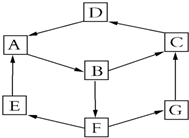 某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:
某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:| 纯A(单质) | B溶液 | D固体 | G溶液 | |
| 颜色 | 银白色 | 黄色 | 红棕色 | 浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 嫦娥一号 | 液氢(H2) | ①2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 ②2H2(l)+O2(l)=2H2O(g)△H=-482.6kJ•mol-1 |
| 祥云火炬 | 丙烷 (C3H8) | ③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1 ④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基戊烷也称为新戊烷 | B. | 由苯制取溴苯的反应属于加成反应 | ||
| C. | C2H4Br2有2种同分异构体 | D. | 乙醇和乙酸均为非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过氧化氢和臭氧都是常见的绿色氧化剂,工业生产中有着重要用途.
过氧化氢和臭氧都是常见的绿色氧化剂,工业生产中有着重要用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别与其他分散系的本质特征是分散质的粒子直径在1-100nm之间 | |
| B. | 用平行光照射CuSO4溶液和氢氧化铁胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴到NaOH溶液中,一制取氢氧化铁胶体 | |
| D. | 树林中的晨曦,该现象与丁达尔效应有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com