
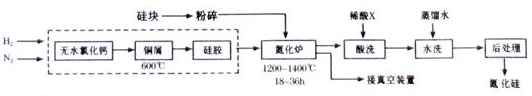
分析 (1)根据信息:四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,除生成氮化硅外还有氯化氢生成;
(2)①Cu能与氧气反应,硅胶具有吸水性;
②控制氮气的流速是防止温度过高,体系中要通入适量的氢气可将氧气转化为水蒸气;
③氮化硅能与HF酸反应,盐酸、稀硫酸均不与Cu反应,氮化硅中混有铜粉;
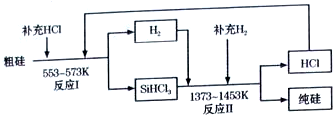
(3)①SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气;
②反应生产1mol纯硅需补充HCl:$\frac{3}{90%}$-3,需补充H2:$\frac{1}{93.75%}$-1,据此进行计算.
解答 解:(1)由信息:四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,可得较高纯度的氮化硅以及氯化氢,反应的化学方程式为:3SiCl4+2N2+6H2$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl,
故答案为:3SiCl4+2N2+6H2$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl;
(2)①Cu能与氧气反应,则Cu屑的作用为除去原料气中的氧气;硅胶具有吸水性,可除去生成的水蒸气,
故答案为:除去原料气中的氧气;除去生成的水蒸气;
②氮化炉中3SiO2(s)+2N2(g)=Si3N4(s)△H=-727.5kJ/mol,该反应为放热反应,开始时严格控制氮气的流速以控制温度是防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触;体系中要通入适量的氢气是为将体系中的氧气转化为水蒸气,而易被除去(或整个体系中空气排尽),
故答案为:该反应为放热反应,防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触;将体系中的氧气转化为水蒸气,而易被除去(或将整个体系中空气排尽);
③氮化硅能与HF酸反应,盐酸、稀硫酸均不与Cu反应,氮化硅中混有铜粉,为除去混有的Cu,可选择硝酸,Cu与硝酸反应,而氮化硅与硝酸不反应,
故答案为:硝酸;
(3)①SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气,反应的化学方程式为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl,
故答案为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl;
③反应生产1mol纯硅需补充HCl:$\frac{3}{90%}$-3,需补充H2:$\frac{1}{93.75%}$-1,补充HCl与H2的物质的量之比=($\frac{3}{90%}$-3):($\frac{1}{93.75%}$-1)≈5:1,
故答案为:5:1.
点评 本题考查氮化硅的制备实验方案的设计,题目难度中等,明确制备实验的装置中各部分的作用及物质的性质是解答本题的关键,注意掌握制备方案设计的原则,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
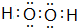 ,其中中心原子的杂化方式为sp3.
,其中中心原子的杂化方式为sp3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78克苯中含有碳碳双键的数目为3NA | |
| B. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| C. | 标准状况下,2.24LCCl4所含分子数为0.1NA | |
| D. | 0.2mol金属钠与足量的O2反应,产物中离子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏水中滴加浓H2SO4,Kw不变 | |
| B. | CaCO3不易溶于稀硫酸,也不易溶于醋酸 | |
| C. | NaCI溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 在Na2S稀溶液中,c(H+)=c( OH-)-2c(H2S)-c(HS-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | 最高价氧化物的水化物的酸性:Y>Z | |
| C. | 化合物WZ2中各原子均满足8电子的稳定结构 | |
| D. | Y、Z均能与碳元素形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Y>X | |
| B. | Z与W形成的化合物在熔融状态下能导电 | |
| C. | 电解Y、W形成的化合物,无论是熔融状态下还是水溶液中,都能得到单质W | |
| D. | 单质X与单质Y加热条件下能生成白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  | 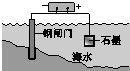 |
| 钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀 | 钢铁表面水膜的酸 性较强,发生析氢 腐蚀 | 将锌板换成铜板对 钢闸门保护效果更好 | 钢闸门作为阴极而受到保护 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com