
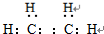 ,B的结构简式
,B的结构简式 或
或 .
.分析 A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,B是一种比水轻的油状液态烃,B仅由碳氢两种元素组成,因碳元素与氢元素的质量比为12:1,求得碳氢元素的个数比为1:1,即化学式CxHx,B的相对分子质量为78.得12x+1x=78,x=6,故B的分子式为C6H6,所以B为苯,结合对应物质的结构和性质与题目要求解答该题.
解答 解:A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,B是一种比水轻的油状液态烃,B仅由碳氢两种元素组成,因碳元素与氢元素的质量比为12:1,求得碳氢元素的个数比为1:1,即化学式CxHx,B的相对分子质量为78.得12x+1x=78,x=6,故B的分子式为C6H6,所以B为苯,
(1)由以上分析可知A为乙烯,对应的电子式为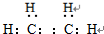 ,B为苯,结构简式为:
,B为苯,结构简式为: 或
或  ,
,
故答案为: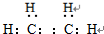 ;
; 或
或  ;
;
(2)A相邻的同系物C为CH2=CHCH3,使溴水褪色发生加成反应,该反应为:CH2=CHCH3+Br2→CH2BrCHBrCH3,
故答案为:CH2=CHCH3+Br2→CH2BrCHBrCH3;
(3)乙烯中H元素质量分数比苯中H元素质量分数大,故相同质量的乙烯、苯燃烧,乙烯消耗的氧气更多,即等质量的A、B完全燃烧时消耗O2的物质的量A>B,
故答案为:A>B.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析能力的考查,明确A为乙烯B为苯,并熟悉乙烯与苯的化学性质即可解答,注意等质量的乙烯与苯中H的质量分数越大消耗氧气越大,题目难度不大.


科目:高中化学 来源: 题型:选择题
 没食子儿茶素的结构如图所示,关于该物质下列叙述中正确的是( )
没食子儿茶素的结构如图所示,关于该物质下列叙述中正确的是( )| A. | 分子式为C15H12O5 | |
| B. | 遇FeCl3溶液不发生显色反应 | |
| C. | 1mol该物质与4molNaOH恰好完全反应 | |
| D. | 易发生氧化反应和取代反应,难发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若溶质为NaA,溶液中可能存在:c (OH-)=c(H+)+c(HA) | |
| B. | 若c(OH-)>c(H+),溶液中不可能存在c(Na+)>c(OH-)>c(A-)>c(H+) | |
| C. | 溶液中可能存在c(Na+)>c(A-)>c(H+)>c(OH-) | |
| D. | 若溶质为NaA和HA,则一定存在c(A-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg、Na | B. | Al、Mg | C. | Fe、Cu | D. | Fe、Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于80% | B. | 略小于80% | C. | 略大于80% | D. | 等于20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸易溶于水,而乙烷难溶于水 | |
| B. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| C. | 甲苯能使高锰酸钾溶液褪色,甲烷和苯不能使高锰酸钾溶液褪色 | |
| D. | 乙醛与Ag(NH3)2 OH 1:2 反应.而甲醛为 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com