
分析 根据题给总反应式可知,H2在负极反应,氧气在正极反应,酸性条件下,正极反应为O2+4H++4e-=2H2O;碱性条件下,负极反应为2H2-4e-+4OH-=4H2O,其正极反应为:O2+2H2O+4e-=4OH-,以此解答该题.
解答 解:根据反应式可知H2在反应中被氧化,O2被还原,H2应在负极发生反应,O2在正极反应;
燃料与氧气燃烧的总化学方程式为2H2+O2=2H2O,电解质溶液为酸时,正极反应为:O2+4H++4e-=2H2O;
如果电解质为碱,则负极反应式为:2H2-4e-+4OH-=4H2O,其正极反应为:O2+2H2O+4e-=4OH-,故答案为:O2+4H++4e-=2H2O;2H2-4e-+4OH-=4H2O;O2+2H2O+4e-=4OH-.
点评 本题考查原电池的工作原理,题目难度不大,注意依据原电池的原理应用,首先考虑原电池反应所依据的氧化还原反应,再考虑产物与电解质溶液的反应.


科目:高中化学 来源: 题型:填空题
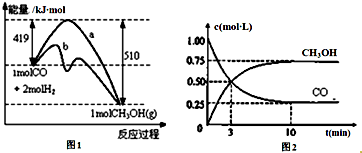 工业上用CO生产燃料甲醇.一定温度和容积条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.请回答下列问题:
工业上用CO生产燃料甲醇.一定温度和容积条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 已知P(红磷,s)=P(白磷,s)△H>0,则白磷比红磷稳定 | |
| B. | 测定相同物质的量浓度的Na2CO3、Na2SiO3的溶液pH,发现后者的更高,说明碳的非金属性强于硅 | |
| C. | 温度和压强一定时,对于可逆反应:2NO2(g)?N2O4(g),混合气体的密度不再改变,则反应达到平衡状态. | |
| D. | 将NaAlO2溶液与NaHCO3溶液混合后生成白色沉淀,是两种溶液水解相互促进的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
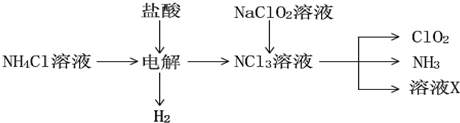
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在食品袋中放入硅胶、生石灰的透气小袋,可防止食物受潮、氧化变质 | |
| B. | 天然气、酒精和汽油分别属于化石能源、不可再生能源和二次能源 | |
| C. | 富含N、P元素的生活用水可以直接用来灌溉农田 | |
| D. | 酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化的原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,判断下列物质不能与B发生化学反应的有C.
,判断下列物质不能与B发生化学反应的有C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用装置制备Fe(OH)2并能较长时间观察其颜色 | |
| B. |  用装置制备并收集少量氨气 | |
| C. |  用装置除去H2S中的水蒸气 | |
| D. |  用装置制取纯净的乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com