
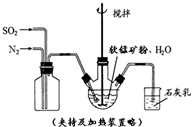
 高纯MnCO3是制备高性能磁性材料的主要原料.某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
高纯MnCO3是制备高性能磁性材料的主要原料.某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
分析 (1)反应装置中石灰乳是用来吸收尾气的,实验中的尾气中含有二氧化硫,用石灰乳吸收;
(2)选择Mn2+的浸出率最大、MnS2O6的生成率最小时温度;
(3)二氧化锰有氧化性,能分别和亚铁离子、二氧化硫发生氧化还原反应,再调节溶液pH将铁离子转化为氢氧化铁沉淀除去;
(4)根据平衡移动的原理,当生成物的浓度减少时,平衡向正反应方向移动,CuS比MnS更难溶,MnS不断溶解生成更难溶的CuS;
(5)④中加入NH4HCO3后,有浅红色的沉淀生成为碳酸锰,生成的无色气体为二氧化碳;
(6)MnCO3难溶于水和乙醇,但潮湿时易被空气氧化,所以不能用水洗涤,而用乙醇洗涤,同时乙醇易挥发,所以可以在100℃以下干燥.
解答 解:(1)反应装置中石灰乳是用来吸收尾气的,实验中的尾气中含有二氧化硫,用石灰乳吸收,反应的化学方程式为Ca(OH)2+SO2═CaSO3+H2O,
故答案为:Ca(OH)2+SO2═CaSO3+H2O;
(2)当温度150℃以上时,MnS2O6的生成率几乎为0,高于30℃以上Mn2+的浸出率提高不大,“浸锰”的适宜温度是150℃(或150℃以上),
故答案为:150℃(或150℃以上);
(3)二氧化锰有氧化性,能氧化二价铁离子和二氧化硫,所以②中加入一定量纯MnO2粉末,能将Fe2+氧化为Fe3+,将过量的SO2氧化除去,再调节溶液pH将铁离子转化为氢氧化铁沉淀除去,
故答案为:将Fe2+氧化为Fe3+,将过量的SO2氧化除去;
(4)③中所得的滤液中含有Cu2+,添加过量的难溶电解质MnS,CuS比MnS更难溶,所以MnS不断溶解,MnS(S)?Mn2+(aq)+S2-(aq)、S2-(aq)+Cu2+(aq)?CuS(S)平衡右移,使Cu2+除去,
故答案为:MnS(S)?Mn2+(aq)+S2-(aq)、S2-(aq)+Cu2+(aq)?CuS(S) 生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去;
(5)④中加入NH4HCO3后,有浅红色的沉淀生成为碳酸锰,生成的无色气体为二氧化碳,反应方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,
故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(6)MnCO3难溶于水和乙醇,但潮湿时易被空气氧化,所以不能用水洗涤,而用乙醇洗涤,同时乙醇易挥发,所以可以在100℃以下干燥,
故答案为:防止MnCO3潮湿时被空气氧化、便于在温度低于100℃干燥等.
点评 本题考查物质制备实验,题目综合性,注意对题目信息的应用、控制操作条件与物质的分离提纯,侧重考查学生对知识的综合应用,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
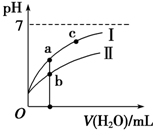 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 25℃时,相同浓度的CH3COONa溶液的碱性大于NaClO溶液 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为2ClO-+CO2+H2O═2HClO+CO${\;}_{3}^{2-}$ | |
| C. | 图象 I代表CH3COOH溶液的稀释 | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 加料方式(mol) | H2的体积分数 | ||||
| 物质 | CO(g) | H2O(g) | CO2(g) | H2(g) | |
| 加料一 | 1 | 3 | 0 | 0 | a% |
| 加料二 | 0 | 1.2 | 0.6 | 0.6 | b% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg和Zn | B. | Mg和Al | C. | Fe和Zn | D. | Cu和Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com