
绿矾(FeSO4·7H2O)硫酸法生产一种稀有金属产品过程中产出的副产品,产品外观为淡绿色或淡黄绿色结晶固体。加入适量可调节碱性水中的pH,与水中悬浮物有机结合,并加速沉淀,主要应用于水质净化和工业废水处理,同时具有杀菌作用。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为 (保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为 (填>、<、=)40% 。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为 。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200 mL 2 mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+=6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+=3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+= NO↑+3Fe3++2H2O
① V值范围 ;
② 若V=48,试计算混合物中CuS的质量分数 (保留两位小数)。
(1)7.14 mol·L-1 ; >(各2分) (2)0.77(2分)
(3)FeSO4·Fe2(SO4)3·10H2O (3分) (4)①42~60mL(3分);②0.33或1/3(3分)
【解析】
试题分析:(1)密度为1.4g/cm3,50%的硫酸物质的量浓度为:
c= =7.14 mol·L-1,
=7.14 mol·L-1,
50%的硫酸与30%的硫酸等体积(假设羰基为1,密度分别是ρ1和ρ2)混合,混合酸的浓度为
 >40%。
>40%。
(2)因为20%发烟硫酸为80克H2SO4含SO3 20克, ,
,
若用SO3·nH2O表示20%的发烟硫酸,则n=0.77。
(3)配制溶液加入足量的BaCl2溶液,过滤得沉淀9.32克,n(SO42-)= =0.04mol;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化(2Fe2++Cl2==2Fe3++2Cl-),n(Fe2+)=2×
=0.04mol;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化(2Fe2++Cl2==2Fe3++2Cl-),n(Fe2+)=2× =0.01mol;由电荷守恒n(Fe3+)=0.02mol, 7.32克晶体含有0.01molFeSO4为1.52g、0.01mol Fe2(SO4)3为4.00g,还有H2O为1.80g即0.1mol,晶体的化学式FeSO4·Fe2(SO4)3·10H2O。
=0.01mol;由电荷守恒n(Fe3+)=0.02mol, 7.32克晶体含有0.01molFeSO4为1.52g、0.01mol Fe2(SO4)3为4.00g,还有H2O为1.80g即0.1mol,晶体的化学式FeSO4·Fe2(SO4)3·10H2O。
(4)假设固体混合物全部为CuS,则n(CuS)= =0.09mol,需要硝酸的物质的量为y,
=0.09mol,需要硝酸的物质的量为y,
8NO3-+3CuS + 8H+==3Cu2++3SO42-+8NO↑+4H2O,
3 8
0.09mol y
y=0.24mol
剩余的硝酸的物质的量为:0.4mol-0.24mol=0.16mol。
0.112mol硝酸和(NH4)2Fe(SO4)2溶液完全反应。
NO3-+3Fe2++4H+==NO↑+3Fe3++2H2O
3mol 4
1×10-3VL×2mol/L 0.16mol,解得V=60,
所以V值范围为:42<V<60,
②若V=48,与48mL(NH4)2Fe(SO4)2溶液完全反应需要硝酸的物质的量为:
NO3-+3Fe2+ + 4H+→NO↑+3Fe3++2H2O
3mol 4
0.048L×2mol/L n
解得:n=0.128mol,
故与固体混合物反应的硝酸的物质的量为:0.4mol-0.128mol=0.272mol,
设Cu2S的物质的量xmol,CuS的物质的量为ymol,160x+96y=8.64g①.
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
3 16
x 16x/3
8NO3-+3CuS+8H+→3Cu2++3SO42-+8NO↑+4H2O,
3 8
y 8y/3
16x/3+8y/3=0.272②
由①②解得:x=0.036; y=0.03
混合物中CuS的质量分数为: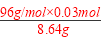 ×100%≈33.33%。
×100%≈33.33%。
考点:化学与技术。考查硫酸的浓度变化特点、铜的硫化物与硝酸反应的计算。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014湖南省衡南县高一下学期期末考试化学试卷(解析版) 题型:选择题
环境污染已成为人类社会面临的重大威胁,各种污染数不胜数。下列名词与环境污染无关的是
①温室效应 ②赤潮 ③酸雨 ④光化学污染 ⑤臭氧层空洞 ⑥水俣病 ⑦潮汐 ⑧大脖子病
A.①②③ B.⑦⑧ C.①⑤⑥ D.②⑤⑦
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省益阳市高一上学期期末考试化学(理)试卷(解析版) 题型:选择题
为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作①过滤; ②加过量NaOH溶液; ③加过量盐酸; ④加过量Na2CO3溶液; ⑤加过量BaCl2溶液。其中正确的操作顺序
A. ①④②⑤③ B.④①②⑤③ C.②④⑤①③ D.⑤②④①③
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省怀化市高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。

请回答下列问题:
(1)氯化铁有多种用途:
①氯化铁做净水剂。请用离子方程式表示其原理____________ __________;
②工业上常用FeCl3溶液腐蚀铜印刷线路板。这是利用了FeCl3较强的__________性。
(2)吸收剂X的化学式为 。为检验吸收剂是否已完全转化为FeCl3溶液,有人设计用酸性高锰酸钾溶液,但很快被否定,理由是(用离子方程式表示) 。正确的检验方法是:取少量待测液,加入 (写化学式)溶液,若无深蓝色沉淀产生,则证明转化完全。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4  K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
(5)将粗K2FeO4产品经重结晶、过滤、 、 ,即得较纯净的K2FeO4。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省怀化市高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
有机化合物A转化为B的反应如下,下列说法正确的是

A.B的分子式为C16H1O2 B.上述转化属于还原反应
C.二者均为芳香烃 D.二者均能发生加成、酯化反应
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省岳阳市高三教学质量检测二理综化学试卷(解析版) 题型:选择题
化学工作者把烷烃、烯烃、环烷烃、炔烃……的通式转化成键数的通式,给研究有机物分子键能(化学键形成时放出的能量或化学键断裂时吸收的能量)大小的规律带来了很大的方便。设键数为I,则烷烃中碳原子数与键数的关系的通式为CnI3n+1,烯烃(视双键为两条单键)、环烷烃中碳原子数与键数的关系的通式为CnI3n,则苯乙烯的同系物中,碳原子数与键数关系的通式为
A.CnI3n-1 B.CnI3n-2 C.CnI3n-3 D.CnI3n-4
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:实验题
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了Cl元素的非金属性比Br强的实验研究。回答下列问题:
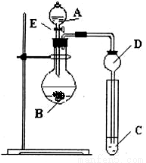
(1)图中E装置名称是_____________。
(2) N、C、Si的非金属性由强到弱的顺序是:_____________;从以下所给物质中选出甲同学设计的实验所用到物质:试剂A为_______;试剂C为_________(填序号)。
①稀HNO3溶液 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2
(3) 乙同学设计的实验中(酒精灯加热装置在图中未画出),若试剂C为溴化钾溶液溶液外,还需要用到的试剂有:试剂A为________;试剂B为 ________。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:选择题
短周期金属元素甲~戊在元素周期表中的相对位置如表所示,
下面判断正确的是

A.氢氧化物碱性:丙>丁>戊 B.金属性:甲>丙
C.原子半径: 丙<丁<戊 D.最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列物质中,不能和氯气发生取代反应的是
A.CH3Cl B.CCl4 C.CH2Cl2 D.CH4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com