
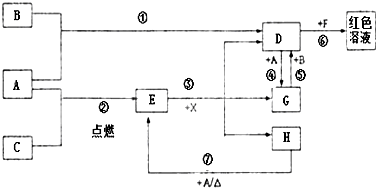
 A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体.它们之间的转化如图所示(某些反应条件和部分反应产物已略去).
A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体.它们之间的转化如图所示(某些反应条件和部分反应产物已略去).分析 单质A和C反应生成E为黑色晶体,E黑色固体和X酸反应生成D、G、H,其中DG之间可以实现相互转化,说明A为变价金属Fe,和C在点燃条件下生成黑色固体E为Fe3O4,C为O2,依据D+A=G说明D为含三价铁离子的化合物,F为含硫氰酸根离子的化合物,G为含Fe2+离子的化合物,H为H2O;依据G+B=D分析判断B是强氧化剂,B为黄绿色气体,证明为Cl2,所以推断D为FeCl3,得到G为FeCl2;X为HCl;依据判断出的物质回答问题.
解答 解:单质A和C反应生成E为黑色晶体,E黑色固体和X酸反应生成D、G、H,其中DG之间可以实现相互转化,说明A为变价金属Fe,和C在点燃条件下生成黑色固体E为Fe3O4,C为O2,依据D+A=G说明D为含三价铁离子的化合物,F为含硫氰酸根离子的化合物,推断为KSCN溶液,G为含Fe2+离子的化合物,H为H2O;依据G+B=D分析判断B是强氧化剂,B为黄绿色气体,证明为Cl2,所以推断D为FeCl3,得到G为FeCl2;X为HCl;
(1)依据分析推断可知,D为FeCl3,X为HCl,
故答案为:FeCl3;HCl;
(2)依据反应过程分析,①为铁和氯气发生的氧化还原反应,②为铁和氧气发生的氧化还原反应,③为四氧化三铁和盐酸发生的复分解反应,不是氧化还原反应,④为氯化铁和铁发生的氧化还原反应,⑤为氯化亚铁和氯气发生的氧化还原反应,⑥是氯化铁和硫氰酸盐发生的复分解反应,不是氧化还原反应,
故答案为:③⑥;
(3)反应⑥是氯化铁和硫氰酸盐发生的复分解反应,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,
故答案为:Fe3++3SCN-=Fe(SCN)3;
(4)往G为FeCl2溶液中加入NaOH溶液观察到的现象是,生成白色氢氧化亚铁沉淀,被空气中氧气氧化为氢氧化铁,现象为生成白色沉淀,迅速变为灰绿色,最终变为红褐色,
故答案为:生成白色沉淀,迅速变为灰绿色,最终变为红褐色;
(5)反应⑦是铁在水蒸气中发生的反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;该反应中符合氧化还原反应的电子守恒,氢元素化合价从+1价变化为0价,4H2O反应转移电子为 8mol,铁元素从0价变化为+$\frac{8}{3}$价,每消耗 0.3mol的A(Fe),可转移电子0.8mol,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;0.8.
(6)除去FeCl3溶液中混有的少量FeCl2的方法是:向混合溶液中通入足量的氯气,
故答案为:向混合溶液中通入足量的氯气.
点评 本题考查了物质转化关系的分析判断,物质性质的应用,反应现象和反应条件的应用是解题关键,主要考查铁及其化合物性质的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正反应速率增大,化学平衡常数增大 | |
| B. | 减小压强,逆反应速率减小,化学平衡常数减小 | |
| C. | 加入催化剂,正逆反应速率不变,平衡不移动 | |
| D. | 充入氧气,正反应速率先增大后减小,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 种 | B. | 6 种 | C. | 7 种 | D. | 8 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA | |
| B. | 标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为2NA | |
| C. | 92 g NO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 100 g 17%的氨水,溶液中含有的NH3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
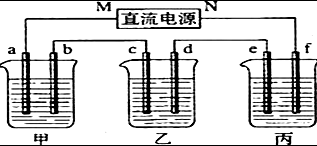 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最终得到7.8g的沉淀 | |
| B. | 反应过程中得到6.72L(标准状况)的气体 | |
| C. | 最终得到的溶液中c(NaCl)=2.0mo/L | |
| D. | 最终得到的溶液中Al元素都以Al(OH)3形式存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com