
 全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )| A. | 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4 | |
| B. | 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g | |
| C. | 石墨烯的作用主要是提高电极a的导电性 | |
| D. | 电池充电时间越长,电池中的Li2S2量越多 |
分析 由电池反应16Li+xS8=8Li2Sx(2≤x≤8)可知负极锂失电子发生氧化反应,电极反应为:Li-e-=Li+,Li+移向正极,所以a是正极,发生还原反应:S8+2e-=S82-,S82-+2Li+=Li2S8,3Li2S8+2Li++2e-=4Li2S6,2Li2S6+2Li++2e-=3Li2S4,Li2S4+2Li++2e-=2Li2S2,根据电极反应式结合电子转移进行计算.
解答 解:A.据分析可知正极可发生反应:2Li2S6+2Li++2e-=3Li2S4,故A正确;
B.负极反应为:Li-e-=Li+,当外电路流过0.02mol电子时,消耗的锂为0.02mol,负极减重的质量为0.02mol×7g/mol=0.14g,故B正确;
C.硫作为不导电的物质,导电性非常差,而石墨烯的特性是室温下导电最好的材料,则石墨烯的作用主要是提高电极a的导电性,故C正确;
D.充电时a为阳极,与放电时的电极反应相反,则充电时间越长,电池中的Li2S2量就会越少,故D错误;
故选D.
点评 本题考查新型电池,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据离子的流向判断原电池的正负极,题目难度中等.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A. | 肉制品中添加适量的亚硝酸钠 | 亚硝酸钠有防腐的作用 |
| B. | 液氨常用作制冷剂 | 液氨汽化时要吸收大量的热 |
| C. | 利用静电除尘装置除去粉尘 | 胶体粒子带电 |
| D. | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化吸收大量的热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
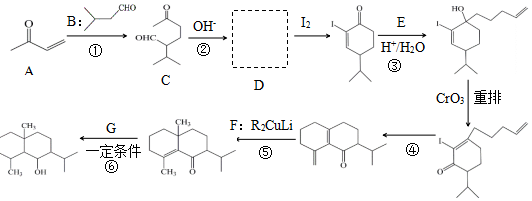
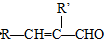 +H2O
+H2O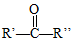 →
→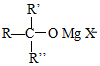 $\stackrel{H+/H_{2}O}{→}$
$\stackrel{H+/H_{2}O}{→}$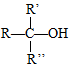

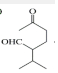 $\stackrel{O{H}^{-}}{→}$
$\stackrel{O{H}^{-}}{→}$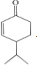 +H2O.
+H2O.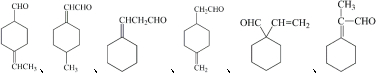
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2•xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
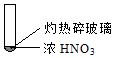 | 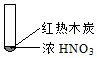 | 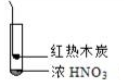 |
| ① | ② | ③ |
| A. | 由①中的红棕色气体,推断产生的气体一定是混合气体 | |
| B. | 红棕色气体不能表明②中木炭与浓硝酸产生了反应 | |
| C. | 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 | |
| D. | ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加c(CO),平衡向正向移动,反应的平衡常数增大 | |
| B. | 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ | |
| C. | 第二阶段,Ni(CO)4分解率较低 | |
| D. | 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
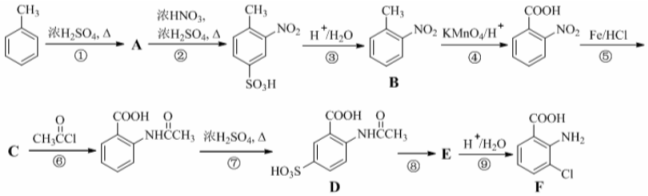

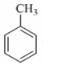 分子中不同化学环境的氢原子共有4种,共面原子数目最多为13.
分子中不同化学环境的氢原子共有4种,共面原子数目最多为13.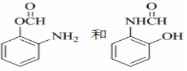 .
. ,该步反应的主要目的是保护氨基.
,该步反应的主要目的是保护氨基. 为主要原料,经最少步骤制备含肽键聚合物的流程.
为主要原料,经最少步骤制备含肽键聚合物的流程.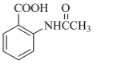 …$→_{反应条件}^{反应试剂}$目标化合物 …$→_{反应条件}^{反应试剂}$目标化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应N2 (g)+3H2 (g)?2NH3 (g)的△H<0,△S>0 | |
| B. | 地下钢铁管道用导线连接锌块可以减缓管道的腐蚀 | |
| C. | 常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4 mol•L-1 | |
| D. | 常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com