
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| B. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)的△H=2×(+283.0)kJ•mol-1 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
分析 A.根据中和热的定义:稀的强酸和强碱稀溶液反应生成1mol水放出的能量来分析;
B.根据燃烧热的定义:完全燃烧1mol物质得到最稳定的产物所放出的热量来回答;
C.需要加热才能发生的反应不一定为吸热反应,有些放热反应必须在加热条件下才能进行;
D.燃烧热的定义:完全燃烧1mol物质得到最稳定的产物所放出的热量.
解答 解:A、中和热是强酸和强碱稀溶液反应生成1mol水放出的能量,故H2SO4和Ca(OH)2反应的中和热△H=-57.3KJ.mol-1,故A错误;
B、因CO(g)的燃烧热是283.0KJ.mol-1,则2CO(g)+O2(g)=2CO2(g)反应的△H=-2×283.0KJ.mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=2×283.0KJ.mol-1,故B正确;
C、有些放热反应必须在加热条件下才能进行,如铝热反应,故C错误;
D、根据燃烧热概念,可燃物应生成稳定氧化物,水应为液态,故D错误.
故选B.
点评 本题考查燃烧热和中和热的概念,抓住概念的实质是判断的关键,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加几滴双氧水后再滴加2滴KSCN溶液,溶液变成血红色,则原溶液中一定含有Fe2+ | |
| B. | 向某溶液中加入盐酸酸化的氯化钡溶液,产生白色沉淀,则原溶液中一定含有SO42- | |
| C. | 向某溶液中加入稀盐酸产生无色气体,产生的气体使澄清石灰水变浑浊,则原溶液中一定有CO32- | |
| D. | 向某溶液中滴加NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液中一定含 有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 废旧显示器必须回收,其主要目的是为了提取其中的贵重金属 | |
| B. | 生活污水中所含的氮、磷化合物是植物营养素,但会导致水体污染 | |
| C. | 二氧化碳和甲烷等会导致“温室效应”,从而引起全球变暖 | |
| D. | 雾霾天气会造成严重的交通问题,雾霾是一种胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
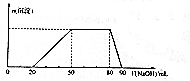 某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )
某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )| A. | 原溶液中一定存在Mg2+、Al3+、H+、SO42- | |
| B. | 原溶液中Al3+的浓度为1mol•L-1 | |
| C. | 原溶液中NH4+的物质的量为0.4mol | |
| D. | 当加入的NaOH的溶液的体积为90mL时,反应后溶液中的离子只有Na+和SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的水溶液是强酸,HBr的水溶液也是强酸 | |
| B. | CO2气体通入Ba(NO3)2溶液中不反应,SO2气体通入Ba(NO3)2溶液中也不反应 | |
| C. | O2与Cu反应生成CuO,S与Cu反应生成CuS | |
| D. | CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HNO3>H2CO3>H2SiO3 | B. | 稳定性;H2S>H2O>HF | ||
| C. | 还原性:Cl->Br->I- | D. | 碱性:NaOH>Mg(OH)2>Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
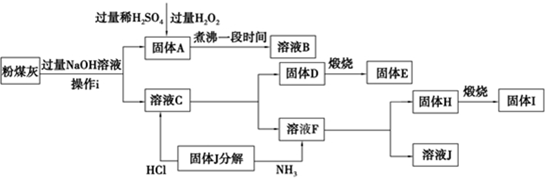
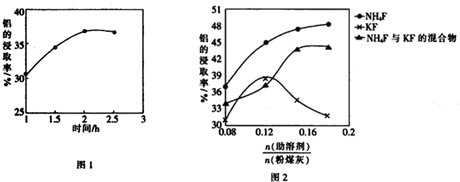
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质一定相同 | |
| B. | 离子化合物中,一定存在金属元素和非金属元素 | |
| C. | 同时含有离子键和共价键的化合物,一定是离子化合物,不可能是共价化合物 | |
| D. | 难失电子的原子,获得电子的能力一定强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| B. | 二氧化碳、甲烷、氮气都是造成温室效应的气体 | |
| C. | 在工业生产中,研制出在较低温度和压强下能使反应迅速进行的催化剂,可起到很好的节能效果,能体现十八大提出的“绿色发展”理念 | |
| D. | 石油裂解、煤的气化、海水制镁都包含化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com