
分析 (1)焦亚硫酸钠放置在空气中很容易被氧化,Na2S2O5中硫元素化合价+4价,硫元素化合价升高为+6价,氧气中氧元素化合价降低;
(2)根据Na2SO3+SO2═Na2S2O5、V=nvm计算;
(3)①Na2S2O5和I2反应,S2O52-中S化合价从+4升高到SO42-中的+6,碘从0价变为-1价,据此书写离子方程式;
②先计算在500 mL混合溶液中溶解I2的物质的量,根据反应2S2O32-+I2=2I-+S4O62-,由碘的物质的量可计算出Na2S2O5的物质的量,据此计算抗氧化剂产品中Na2S2O5质量分数.
解答 解:(1)焦亚硫酸钠放置在空气中很容易被氧化,Na2S2O5中硫元素化合价+4价,硫元素化合价升高为+6价,氧气中氧元素化合价降低,化学方程式为,Na2S2O5+O2=Na2SO4+SO3,所以实验时先用CO2气体尽可能排除装置内空气,防止焦亚硫酸钠被氧化,
故答案为:防止焦亚硫酸钠被氧化;
(2)19.0g Na2S2O5的物质的量为$\frac{19.0g}{190g/mol}$mol=0.1mol,Na2SO3+SO2═Na2S2O5,需标准状况下SO20.1mol,体积为V=nvm=0.1mol×22.4L/mol=2.24L,
故答案为:2.24;
(3)①Na2S2O5和I2反应,I2作氧化剂,碘从0价变为-1价,S2O52-中S化合价从+4升高到SO42-中的+6为还原剂,反应为:S2O52-+2I2+3H2O=2SO42-+4I-+6H+,
故答案为:S2O52-+2I2+3H2O=2SO42-+4I-+6H+;
②在500 mL混合溶液中溶解I2的物质的量为:
n(I2)=0.05000 mol•L-1×100 mL×10-3 L•ml-1=5.00×10-3 mol,
Na2S2O3标准溶液消耗I2物质的量为
n(I2)=$\frac{0.1mol/L×12.00mL×1{0}^{-3}L/mL}{2}$=6.00×0-4 mol
2S2O32-+I2=2I-+S4O62-则在500mL混合溶液中与反应消耗I2物质的量为
n(I2)=5.00×10-3 mol-6.00×10-4 mol×5=2.00×0-3 mol
n(Na2S2O5)=$\frac{2.00×1{0}^{-3}mol}{2}$=1.00×10-3 mol
Na2S2O5的质量分数=$\frac{1.00×1{0}^{-3}mol×190g/mol}{0.2g}$×100%=95%
答:抗氧化剂产品中Na2S2O5质量分数为95%.
点评 本题考查了氧化还原反应有关知识,题目难度中等,明确题中资料信息以及氧化还原反应的原理是解答关键,试题培养了学生的分析、理解能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
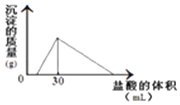 将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL PH=14的溶液,然后用2mol/L的盐酸滴定,可得到沉淀量与消耗的盐酸体积关系如图:则反应过程中产生氢气的总体积为2.016L(标准状况)
将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL PH=14的溶液,然后用2mol/L的盐酸滴定,可得到沉淀量与消耗的盐酸体积关系如图:则反应过程中产生氢气的总体积为2.016L(标准状况)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷是中华民族祖先的一项伟大发明,烧结黏土制陶瓷的过程不涉及化学反应 | |
| B. | 制作烟花的过程中常加入金属发光剂和发色剂使烟花放出五彩缤纷的颜色 | |
| C. | “水滴石穿”主要是溶解了的雨水对石灰石的溶解作用 | |
| D. | 严格地讲通风橱”是一种不负责任的防污染手段,因为实验产生的有害气体没有得到转化或吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
| B |  | 反应结束后,锥形瓶中溶液的溶质是Cu(NO3)2、CuSO4,集气瓶中收集到的气体是NO |
| C | 向1mL浓度均为0.05mol•L-l NaCl、NaI的混合溶液中滴加2滴0.01mol•L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp (AgCl)>Ksp(AgI) |
| D | 室温下,用pH试纸测得0.1mol•L-1 NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸溶解碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\stackrel{催化剂}{→}$NO2 | |
| C. | 生产聚丙烯塑料:nCH=CH-CH3→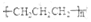 | |
| D. | 制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C具有较强还原性,高温烹饪蔬菜会损失维生素C | |
| B. | 玉米油和鸡蛋清均是高分子化合物,它们均能水解生成氨基酸 | |
| C. | 通过电镀工业可制备铅笔芯,铅笔芯含有大量的铅因此可以导电 | |
| D. | 在水泥路面翻晒的粮食,易受四氯化碳和甲醛等有害物质污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰和水的反应 | B. | 木炭在氧气中发生不完全燃烧 | ||
| C. | 铝热反应 | D. | 氢氧化钡晶体与氯化铵晶体混合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com