
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
科目:高中化学 来源: 题型:填空题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
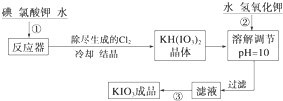
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3 g/100g H2O | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N、P、Mg的原子半径依次减小 | B. | LiOH、KOH、CsOH的碱性依次减弱 | ||
| C. | HF、H2O、SiH4的稳定性依次减弱 | D. | HCl、HBr、HI的酸性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
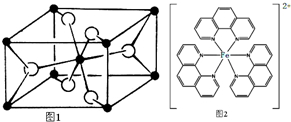
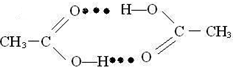 .
.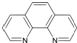 ),它能与Fe2+形成红色配合物(如右图2),
),它能与Fe2+形成红色配合物(如右图2),查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子或化合物 | Cr2O72- | Cr(OH)3 | Cr(OH)4- | Cr3+ | CrO42- |
| 颜色 | 橙色 | 灰蓝色 | 绿色 | 绿色 | 黄色 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取8.10mL稀盐酸 | |
| B. | 用pH计测得某溶液的pH为2.2 | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 可用25mL碱式滴定管量取20.00mL KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com