

分析 煤矸石溶于稀盐酸发生的反应有Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O、FeO+2H+=Fe2++H2O,然后过滤,得到的滤渣为SiO2,向滤液中通入氯气,发生的反应为2Fe2++Cl2=2Cl-+2Fe3+,向溶液中加入碳酸钠,发生的反应为3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑、CO32-+Ca2+=CaCO3↓、Mg2++2H2O?Mg(OH)2+2H+、Fe3++3H2O?Fe(OH)3+3H+,过滤得到的滤液中含有NaCl,向滤渣中加入过量NaOH溶液,Al(OH)3溶解,其余沉淀不溶解,过滤后得到的滤渣II为CaCO3、Mg(OH)2和Fe(OH)3,滤液中含有NaAlO2,向滤液中通入二氧化碳,发生的反应为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-),然后过滤得到Al(OH)3,滤液II中含有NaHCO3或碳酸钠,以此解答该题.
解答 解:煤矸石溶于稀盐酸发生的反应有Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O、FeO+2H+=Fe2++H2O,然后过滤,得到的滤渣为SiO2,向滤液中通入氯气,发生的反应为2Fe2++Cl2=2Cl-+2Fe3+,向溶液中加入碳酸钠,发生的反应为3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑、CO32-+Ca2+=CaCO3↓、Mg2++2H2O?Mg(OH)2+2H+、Fe3++3H2O?Fe(OH)3+3H+,过滤得到的滤液中含有NaCl,向滤渣中加入过量NaOH溶液,Al(OH)3溶解,其余沉淀不溶解,过滤后得到的滤渣II为CaCO3、Mg(OH)2和Fe(OH)3,滤液中含有NaAlO2,向滤液中通入二氧化碳,发生的反应为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-),然后过滤得到Al(OH)3,滤液II中含有NaHCO3或碳酸钠,
(1)酸浸过程中金属氧化物都和稀盐酸反应生成氯化物,主要离子反应方程式为Al2O3+6H+=2Al3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O;
(2)通过以上分析知,滤渣II的成分为CaCO3、Mg(OH)2和Fe(OH)3,故答案为:Fe(OH)3;
(3)①水解时生成二氧化碳气体、转化时需要二氧化碳,在水解是需要碳酸钠、在转化时得到碳酸氢钠或碳酸钠,所以能循环利用的是CO2(或Na2CO3),
故答案为:CO2(或Na2CO3);
②通过以上分析知,转化时发生的离子反应方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-),
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-).
点评 本题考查制备实验方案设计,为高考高频点,此种题型涉及物质性质、实验基本操作,明确物质的性质及每一步发生的反应、基本操作方法是解本题关键,熟练掌握元素化合物知识,灵活运用知识解答问题,题目难度中等.


科目:高中化学 来源: 题型:解答题
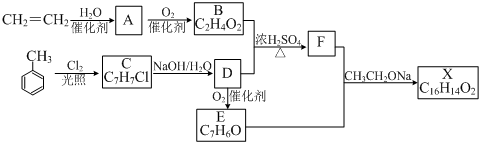
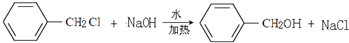 ,反应类型为水解反应或取代反应.
,反应类型为水解反应或取代反应.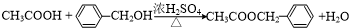 .
.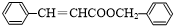 .
.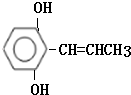 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ω=4;⑤
Ω=4;⑤ Ω=2;⑥
Ω=2;⑥ Ω=4.
Ω=4.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
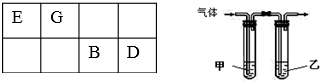
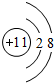 .
.| 实验编号 | X物质的量浓度(mol•L-1) | Y物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 待测溶液NaOH的 体积/mL | 标准盐酸溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 30.30 |
| 3 | 25.00 | 0.22 | 26.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
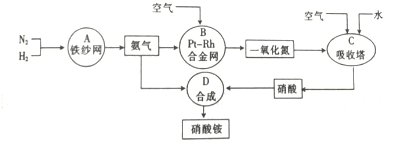
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com