
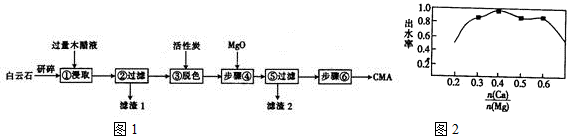
分析 根据流程图可知,白云石(主要成分MgCO3•CaCO3,含SiO2等杂质)与木醋液(主要成分乙酸)反应生成醋酸钙和醋酸镁,过滤得滤渣1为二氧化硅,滤液中主要溶质是醋酸钙和醋酸镁,加入活性碳脱色,再加入氧化镁,调节溶液中n(Ca):n(Mg)的值,过滤,除去混合液中固体杂质,得醋酸钙和醋酸镁溶液,将滤液蒸发结晶、过滤、洗涤及干燥得CMA,据此答题.
(1)“研磨”可以增大反应物之间的接触面积,反应速度快且充分;
(2)由工艺流程可知,步骤①中发生反应本质为碳酸镁、碳酸钙分别与乙酸的反应;
(3)步骤②所得滤渣1的主要成分为二氧化硅,化学式为SiO2;
(4)金属氧化物MgO能与酸反应产生盐和水,所以加入MgO的作用是除去过量的乙酸;
(5)根据如图2所示钙、镁的物质的量之比与出水率(与融雪效果成正比)关系分析;
(6)若反应过程中消耗3molCH3COOH,且CMA的质量为221g,则根据乙酸根守恒、质量守恒分析解答.
解答 解:(1)“研磨”可以增大反应物之间的接触面积,反应充分速度快,
故答案为:增大接触面积,加快反应速率;
(2)根据上面的分析可知,步骤①发生的反应离子方程式为 MgCO3•CaCO3+4CH3COOH=Ca2++Mg2++4CH3COO-+2CO2↑+2H2O,
故答案为:MgCO3•CaCO3+4CH3COOH=Ca2++Mg2++4CH3COO-+2CO2↑+2H2O;
(3)白云石与木醋液反应生成醋酸钙和醋酸镁,二氧化硅与乙酸不反应,所以步骤②所得滤渣1的主要成分为二氧化硅,化学式为SiO2,
故答案为:SiO2;
(4)金属氧化物MgO能与乙酸反应产生乙酸镁和水.所以加入MgO的作用是除去过量的乙酸,
故答案为:除去过量的乙酸;
(5)根据如图2所示钙、镁的物质的量之比与出水率(与融雪效果成正比)关系,可知,当n(Ca):n(Mg)为0.4时,出水率最高为1,所以则$\frac{n(Ca)}{n(Mg)}$=0.4时,融雪效果最好,故答案为:0.4;
(6)CMA(醋酸钙和醋酸镁固体的混合物),CMA的质量为221g,设(CH3COO)Ca、(CH3COO)Mg的物质的量分别为x、y,则158x+142y=221g,2x+2y=3mol,解得:x=0.5mol,y=1mol,则CMA中醋酸钙和醋酸镁的物质的量之比为1:2,
故答案为:1:2.
点评 本题考查CMA的工艺流程,侧重考查学生阅读题目获取信息能力、对工艺流程的理解、物质分离提纯与条件控制等,综合性较强,题目难度中等,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 六水氯化钙可用作食品干燥剂 | |
| B. | 生石灰作干燥剂是物理变化 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| D. | “血液透析”利用了胶的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 水/硝酸钙 | 0.8:1 | 0.9:1 | 0.95:1 | 1:1 | 1.05:1 | 1.1:1 | 1.15:1 |
| 浸出率/% | 83.1 | 94.5 | 98.2 | 99.1 | 99.5 | 99.6 | 99.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 60% | C. | 40% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 加入氢氧化钠溶液,通过分液的方法,可以除去苯中的乙酸 | |
| C. | 将氢气和氧气的混合气体通过灼热的氧化铜,以除去其中的氢气 | |
| D. | 用萃取的方法分离汽油和煤油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 分子中,处于同一平面上的原子数最多可能16个.
分子中,处于同一平面上的原子数最多可能16个.
 、
、 (写结构简式).
(写结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com