
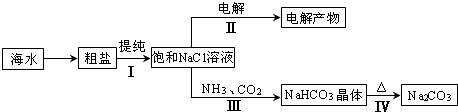
����̼���ƾ���(Na2CO3��10H2O)������0.5 mol/L��Na2CO3��Һ1000 mL����������������ȷ�����������������������Һ��Ũ��ƫ�ߵ���(����)ƫ�͵���(����)
A����ȡ̼���ƾ���100 g
B������ʱ�����ӹ۲�̶���
C����Һʱ���������ܽ�̼���ƾ�����ձ�û�н��г�ϴ
D�����ݺ�����ƿ���ȣ�����ʱ����Һ����ڿ̶��ߣ������ּ�������ˮ���̶���
|
�������������һ�����ʵ���Ũ����Һ����Ƶ�ʵ����̣��йؼ�����׳��ֵ�����ϰ�⣬�������������Ļ���������ʵ�鼼�ܼ��ɣ�A��׳�������0.5 mol/L��1 L��0.5 mol��Na2CO3�����ʵ������ó�������53 g������100 g��53 g��Ϊƫ�ߣ�ʵ����Ӧ��Na2CO3��10H2O������0.5 mol��286 g/mol��143 g������A��Ӧƫ�ͣ�B���ʱҺ�����͵���ڿ̶��ߣ���ʵ�ʼ�ˮ������Ӧ��ˮ������˿ɵ���Ũ��ƫ�ߣ�C�������ϡ�ͻ��ܽ���ձ����粻��ˮϴ�����β���ϴ��Һת������ƿ����ʹ������ʧ��ʹ������ҺŨ��ƫ�ͣ�D��ݺ������ú���Һ����ڿ̶��ߣ���������Һ��մ��ƿ�ں�ĥ�ڴ����£��������ƫ�����ˮʹ������ҺŨ��ƫ�ͣ� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����


| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�걱���к�����������ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
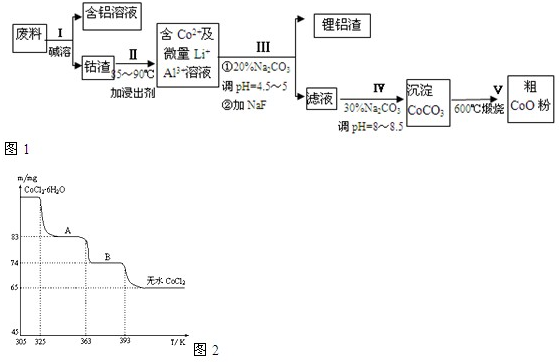
һ�ֺ�����ﮡ��ܵ����͵��Ӳ��ϣ������в����ķ��������ɹۣ������е����Խ�����������ʽ���ڣ�����Co2O3��CoO����ʽ���ڣ������������ĵ����˫�棻﮻��������С�
�ӷ����л��������ܣ�CoO���Ĺ����������£�

��1������I�в���NaOH��Һ�ܳ������е�Al����Ӧ�����ӷ���ʽΪ ��
��2������II�м���ϡH2SO4�ữ���ټ���Na2S2O3��Һ�����ܡ�������ܵĻ�ѧ��Ӧ����ʽΪ��������ֻ��һ������� ����ʵ����ģ�ҵ����ʱ��Ҳ������������ܣ���ʵ�ʹ�ҵ�����в������ᣬ��ӷ�Ӧԭ������������������ܵ���Ҫԭ��_______________��
��3�����̢�õ����������Ҫ�ɷ���LiF��Al(OH)3��̼������Һ�ڲ���Al(OH)3ʱ����Ҫ���ã���д���÷�Ӧ�����ӷ���ʽ____________________��
��4��̼������Һ�ڹ���III��IV����������������ͬ����д���ڹ���IV�����������__________��
��5����Na2CO3��Һ�д��ڶ������ӣ����и�����Ũ�ȹ�ϵ��ȷ����______������ţ���
A��c(Na+) = 2c(CO32-)
B��c(Na+) > c(CO32-) > c(HCO3-)
C��c(OH-) > c(HCO3-) > c(H+)
D��c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3)
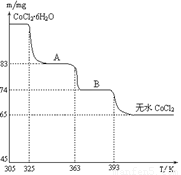
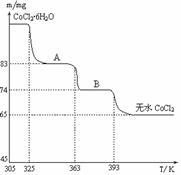
��6��CoO��������ɵ÷ۺ�ɫ��CoCl2��Һ��CoCl2���ᾧˮ��Ŀ��ͬ�����ֲ�ͬ��ɫ��������ɫ����ˮCoCl2��ˮ��ɫ��һ���ʿ��Ƴɱ�ɫˮ�������īˮ����ͼ�Ƿۺ�ɫ��CoCl2��6H2O�������ȷֽ�ʱ��ʣ������������¶ȱ仯�����ߣ�A���ʵĻ�ѧʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�ֺ�����ﮡ��ܵ����͵��Ӳ��ϣ������в����ķ��������ɹۣ������е����Խ�����������ʽ���ڣ�����Co2O3��CoO����ʽ���ڣ������������ĵ����˫�棻﮻��������С�
�ӷ����л��������ܣ�CoO���Ĺ����������£�
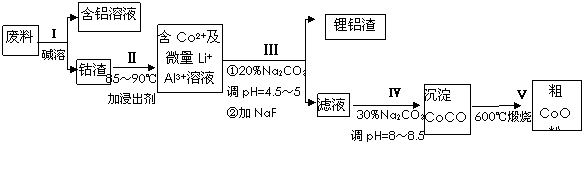
��1������I�в���NaOH��Һ�ܳ������е�Al����Ӧ�����ӷ���ʽΪ�������������� ��
��2������II�м���ϡH2SO4�ữ���ټ���Na2S2O3��Һ�����ܡ�������ܵĻ�ѧ��Ӧ����ʽΪ��������ֻ��һ��������������������� ����ʵ����ģ�ҵ����ʱ��Ҳ������������ܣ���ʵ�ʹ�ҵ�����в������ᣬ��ӷ�Ӧԭ������������������ܵ���Ҫԭ��_______________��
��3�����̢�õ����������Ҫ�ɷ���LiF��Al(OH)3��̼������Һ�ڲ���Al(OH)3ʱ����Ҫ���ã���д���÷�Ӧ�����ӷ���ʽ____________________��
��4��̼������Һ�ڹ���III��IV����������������ͬ����д���ڹ���IV�����������__________��
��5����Na2CO3��Һ�д��ڶ������ӣ����и�����Ũ�ȹ�ϵ��ȷ����______������ţ���
A c(Na+) = 2c(CO32-)
B c(Na+) > c(CO32-) > c(HCO3-)
C c(OH-) > c(HCO3-) > c(H+)
D c(OH-) - c(H+) == c(HCO3-) + 2c(H2CO3)
��6��CoO��������ɵ÷ۺ�ɫ��CoCl2��Һ��CoCl2���ᾧˮ��Ŀ��ͬ�����ֲ�ͬ��ɫ��������ɫ����ˮCoCl2��ˮ��ɫ��һ���ʿ��Ƴɱ�ɫˮ�������īˮ����ͼ�Ƿۺ�ɫ��CoCl2��6H2O�������ȷֽ�ʱ��ʣ������������¶ȱ仯�����ߣ�A���ʵĻ�ѧʽ��______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com