
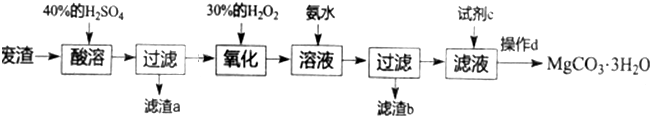
分析 工业废渣(主要成分为MgCO3、Mg2SiO4和少量的SiO2、FeO、Fe2O3、Al2O3),加入40%的硫酸酸溶,过滤后滤液中含有硫酸镁、硫酸亚铁、硫酸铁以及硫酸铝,滤渣为H2SiO3和SiO2,加入H2O2氧化亚铁离子,然后加入氨水调节PH值,铁离子水解生成氢氧化铁,铝离子水解生成氢氧化铝,过滤得滤渣b为氢氧化铁、氢氧化铝,滤液为硫酸镁和硫酸铵的混合溶液,滤液中加入碳酸钠溶液,可生成MgCO3•3H2O沉淀,所以试剂c为Na2CO3,经过滤、洗涤、低温干燥,得到MgCO3•3H2O,以此解答该题.
解答 解:工业废渣(主要成分为MgCO3、Mg2SiO4和少量的SiO2、FeO、Fe2O3、Al2O3),加入40%的硫酸酸溶,过滤后滤液中含有硫酸镁、硫酸亚铁、硫酸铁以及硫酸铝,滤渣a为H2SiO3和SiO2,加入H2O2氧化亚铁离子,然后加入氨水调节PH值,铁离子水解生成氢氧化铁,铝离子水解生成氢氧化铝,过滤得滤渣b为氢氧化铁、氢氧化铝,滤液为硫酸镁和硫酸铵的混合溶液,滤液中加入碳酸钠溶液,可生成MgCO3•3H2O沉淀,所以试剂c为Na2CO3,经过滤、洗涤、低温干燥,得到MgCO3•3H2O,
(1)Al2O3和硫酸反应的离子方程式为Al2O3+6H+=2Al3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O;
(2)加热,温度升高,可增大反应速率,即加快酸溶速率,
故答案为:加热、温度升高;
(3)根据上面的分析,滤渣a的主要成分为H2SiO3和SiO2,
故答案为:H2SiO3和SiO2;
(4)加入H2O2氧化时,将亚铁离子氧化成铁离子,反应的离子方程式为H2O2+2Fe2++2H+═2Fe3++2H2O,
故答案为:H2O2+2Fe2++2H+═2Fe3++2H2O;
(5)根据上面的分析,加入氨水的目的是调节PH值,铁离子水解生成氢氧化铁,铝离子水解生成氢氧化铝,从而除去溶液的铁离子和铝离子,
故答案为:除去溶液的铁离子和铝离子;
(6)根据上面的分析,c试剂为Na2CO3溶液,
故答案为:Na2CO3溶液;
(7)在硫酸镁溶液中加入碳酸钠溶液,可生成MgCO3•3H2O沉淀,经过滤、洗涤、低温干燥,得到MgCO3•3H2O,所以操作d的过程为,
故答案为:过滤、洗涤、低温干燥.
点评 本题考查物质的制备及混合物分离和提纯,明确流程中的方法和基本操作、发生的化学反应是解答的关键,要求学生具有分析和解决问题的能力,题目有利于培养学生的实验能力,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ② | C. | ②③ | D. | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
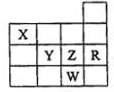
| A. | 常压下五种元素的单质中W单质的沸点最高 | |
| B. | Y、Z和W的阴离子半径依次增大 | |
| C. | X的氢化物比同族元素的氢化物还原性强 | |
| D. | Z元素的最高价氧化物的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、D、T互为同分异构体 | B. | 次氯酸的结构式为 H-Cl-O | ||
| C. | NH4Cl的电子式 为: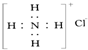 | D. | S2-的结构示意图为: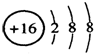 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 酸 | HM | HN | HR |
| 电离常数 K | 9×10-7 | 9×10-6 | 10-2 |
| A. | 三种酸的强弱关系:HM>HN>HR | |
| B. | 反应 HR+N-═HN+R-能够发生 | |
| C. | 相同温度下,0.1 mol/L 的 HM、HN、HR 溶液,HM 溶液 pH 最大 | |
| D. | 相同温度下,1 mol/L HM 溶液的电离常数大于 0.1 mol/L HM |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | [Cu(NH3)4]2+中,存在的化学键有离子键、极性共价键和配位键 | |
| D. | 沉淀溶解后,生成深蓝色的配合物SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com