
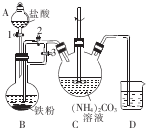
 乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,溶于水,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,溶于水,可由乳酸与FeCO3反应制得.分析 (1)装置B中铁粉与稀盐酸反应生成氢气和氯化亚铁,据此判断反应现象;关闭活塞3、打开活塞2,产生的氢气使圆底烧瓶中压强增大,从而可将氯化亚铁溶液压人装置C;
(2)制得的FeCO3在空气中容易被氧化成铁离子,所以要加少量的铁粉,防止亚铁离子被氧化,反应后加入适量乳酸可以将过量的铁粉溶解,据此答题;
(3)从溶液中获得晶体,应经过冷却结晶、过滤、洗涤、干燥等操作;
(4)先加入硫氰化钾溶液,溶液不变色,然后加入新制氯水,若溶液变为血红色则证明溶液中含有亚铁离子.
解答 解:(1)装置B中铁粉与稀盐酸反应生成氯化亚铁和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,则观察到的现象为:铁粉逐渐溶解,液体中有气泡冒出、溶液变成浅绿色,先关闭活塞3、打开活塞2,铁与稀盐酸反应生成的氢气使圆底烧瓶中压强增大,从而将B中生成的FeCl2溶液压入装置C,
故答案为:液体中有气泡冒出、溶液变成浅绿色;关闭活塞3,打开活塞2;
(2)制得的FeCO3在空气中容易被氧化成铁离子,所以要加少量的铁粉,防止亚铁离子被氧化,反应后加入适量乳酸可以将过量的铁粉溶解,以除去铁粉,
故答案为:防止亚铁离子被氧化;除去铁粉;
(3)在75℃下搅拌使之充分反应制得乳酸亚铁,从热溶液中获得乳酸亚铁晶体,应经过冷却结晶、过滤、洗涤、干燥等操作,
故答案为:冷却结晶(或低温蒸发、冷却结晶);过滤;
(4)证明乳酸亚铁中含Fe2+的方法是:取少量乳酸亚铁溶液于试管中,先加入硫氰化钾溶液,溶液不变色,然后加入新制氯水,若溶液变为血红色则证明溶液中含有亚铁离子,
故答案为:取少量乳酸亚铁溶液于试管中,先加入硫氰化钾溶液,溶液不变色,然后加入新制氯水,若溶液变为血红色则证明溶液中含有亚铁离子.
点评 本题考查了制备方案的设计与评价,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,注意掌握物质制备方案的设计与评价原则,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当反应①中v正(CH4)=v逆(CO)时,表明该反应达平衡状态 | |
| B. | 其他条件不变时,增大体系压强,反应①、②中甲烷的转化率均减小 | |
| C. | 使用高效催化剂可以加快反应速率,同时提高CH4的转化率 | |
| D. | 同一容器内同时发生反应①与②时,容器内温度可能保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③④ | C. | ①②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:
某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铁与硫酸铜溶液反应:2Fe+3Cu2+═2Fe3++3Cu | |
| B. | 碳酸氢钠溶液与氢氧化钠溶液反应:OH-+HCO3-═H2O+CO2↑ | |
| C. | 氢氧化钡溶液与硫酸溶液反应:Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓ | |
| D. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com