
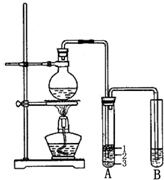
 实验室制取少量溴乙烷的装置如图所示.
实验室制取少量溴乙烷的装置如图所示.
| ||
| ||
| ||
| ||


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
A、澄清透明溶液中:K+ MnO
| ||
| B、含有较多SO32-的溶液:H+ Na+ ClO- Ca2+ | ||
| C、中性溶液中:K+ SO42- Fe3+ Cl- | ||
| D、滴入甲基橙显红色的溶液中:Cl- AlO2- NH4+ Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在河流人海口处易形成三角洲 |
| B、在NaHCO3溶液中滴入CaCl2溶液,看不到沉淀 |
| C、少许FeCl3饱和溶液逐滴滴入沸水中,看不到红褐色沉淀 |
| D、同一支钢笔,同时使用不同牌号的墨水易发生堵塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、184g | B、186g |
| C、212g | D、224g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用蔗糖做食品的甜味剂 |
| B、用甲醛侵泡水产品 |
| C、用干冰保存易腐败的食品 |
| D、用袋装生石灰做饼干类食品的干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
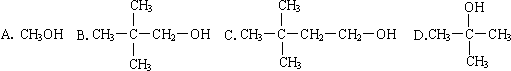
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
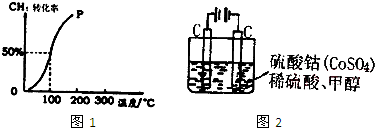
| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | H+ | K+ | NO3-[来源:.Com] | SO42- |
| 物质的量(mol) | 0.5 | 0.1 | 0.6 | 0.15 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com