
【化学一选修2化学与技术】(15分)
已知:①工业上用硫酸与锂辉矿(LiA1Si2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
②氢氧化锂在一定温度下可转化为氧化锂。用β锂辉矿与硫酸等物质制备金属锂的工业流程如下:
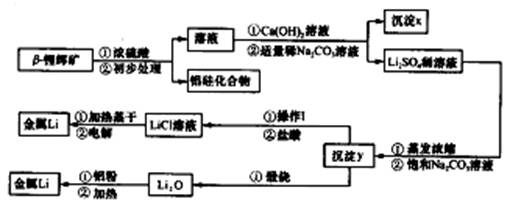
请回答:(1)沉淀y的主要成分的化学式是 。
(2)流程中使用了不同浓度的Na2CO3溶液,从物质溶解度大小的角度解释其浓度不同的原因是 。
(3)操作I涉及的实验方法是 。
(4)写出用铝粉还原法制取金属锂的化学方程式 。
(5)LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂。电解时产生的氯气中混有少量氧气,产生氧气的原因是 。
(6)目前电池通常使用金属锂的优点是 。
(1)Li2CO3(2分)
(2)加稀Na2CO3溶液既能除去溶液中的Ca2+,又不生成Li2CO3沉淀;(2分)
加饱和Na2CO3溶液的目的是使Li +转化生成Li2CO3沉淀。(1分)(其他合理答案参照给分)
(3)过滤、洗涤(各1分)
(4)3 Li2O +4Al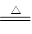 2 Al2O3+3Li
(3分)
2 Al2O3+3Li
(3分)
(5)LiCl溶液在加热蒸干过程中有部分LiOH生成,LiOH受热分解为Li2O,熔融的Li2O电解生成氧气。(3分)
(6)锂的密度小,质能比高;锂电池为可充电绿色环保电池。(2分,其它合理答案也给分)
【解析】(1)硫酸锂和碳酸钠反应的生成物是硫酸钠和碳酸锂,根据Y灼烧的产物是氧化锂可知,Y是碳酸锂。
(2)第一次用稀碳酸钠溶液,是为了防止生成碳酸锂,同时又可以除去钙离子。而第二次是为了生成碳酸锂,所以浓度要大。
(3)从溶液中分离出固体的方法应是过滤,过滤后晶体必须洗涤。
(4)在加热的条件下,铝可以发生铝热反应,方程式为3 Li2O +4Al 2 Al2O3+3Li。
2 Al2O3+3Li。
(5)电解池中氯离子在阳极放电,有氧气生成,说明氧离子在阳极也放电,这是由于LiCl溶液在加热蒸干过程中有部分LiOH生成,LiOH受热分解为Li2O,熔融的Li2O电解生成氧气。
6)锂的密度小,质能比高;锂电池为可充电绿色环保电池。


科目:高中化学 来源: 题型:
| 放电 | 通电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
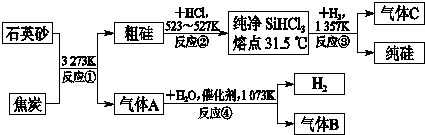
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学一选修2化学与技术】(15分)
已知:①工业上用硫酸与锂辉矿(LiA1Si2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
②氢氧化锂在一定温度下可转化为氧化锂。用β锂辉矿与硫酸等物质制备金属锂的工业流程如下:
请回答:(1)沉淀y的主要成分的化学式是 。
(2)流程中使用了不同浓度的Na2CO3溶液,从物质溶解度大小的角度解释其浓度不同的原因是 。
(3)操作I涉及的实验方法是 。
(4)写出用铝粉还原法制取金属锂的化学方程式 。
(5)LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂。电解时产生的氯气中混有少量氧气,产生氧气的原因是 。
(6)目前电池通常使用金属锂的优点是 。
查看答案和解析>>
科目:高中化学 来源:2012届河北省冀州市中学高三联排考试化学试卷(带解析) 题型:填空题
【化学一选修2化学与技术】(15分)
已知:①工业上用硫酸与锂辉矿(LiA1Si2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
②氢氧化锂在一定温度下可转化为氧化锂。用β锂辉矿与硫酸等物质制备金属锂的工业流程如下: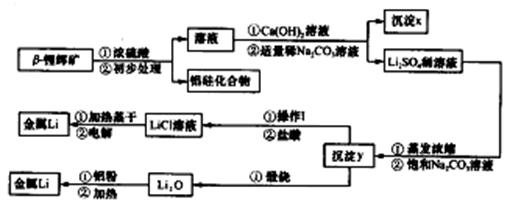
请回答:(1)沉淀y的主要成分的化学式是 。
(2)流程中使用了不同浓度的Na2CO3溶液,从物质溶解度大小的角度解释其浓度不同的原因是 。
(3)操作I涉及的实验方法是 。
(4)写出用铝粉还原法制取金属锂的化学方程式 。
(5)LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂。电解时产生的氯气中混有少量氧气,产生氧气的原因是 。
(6)目前电池通常使用金属锂的优点是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com