

 ;工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,请写出电解反应方程式2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;在电解过程中阳极(填“阴”或“阳”)需要定期补充.
;工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,请写出电解反应方程式2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;在电解过程中阳极(填“阴”或“阳”)需要定期补充.分析 (1)铝离子的核电荷数为13,核外电子总数为10,最外层为8个电子;工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝生成铝和氧气,因为石墨易与氧气反应消耗,所以阳极需要定期补充;
(2)①根据两性氢氧化物能与碱反应生成盐和水;
②根据Be(NO3)2溶液中逐滴加入等浓度的NaOH先后发生反应:Be(NO3)2+2NaOH=Be(OH)2↓+2NaNO3,Be(OH)2+2NaOH═Na2BeO2+2H2O,先产生沉淀,然后沉淀消失,两次消耗的氢氧化钠的物质的量都为0.02mol(即20mLNaOH溶液),产生的Be(OH)2沉淀为0.01mol.
解答 解:(1)铝离子的核电荷数为13,最外层达到8电子稳定结构,铝离子结构示意图为 ,工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝生成铝和氧气,方程式为:2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,因为石墨易与氧气反应消耗,所以阳极生成氧气消耗石墨需要定期补充;
,工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝生成铝和氧气,方程式为:2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,因为石墨易与氧气反应消耗,所以阳极生成氧气消耗石墨需要定期补充;
故答案为: ;2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;阳;
;2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;阳;
(2)①Be(OH)2溶于NaOH反应的生成Na2BeO2和水,反应的化学方程式为:Be(OH)2+2NaOH═Na2BeO2+2H2O;故答案为:Be(OH)2+2NaOH═Na2BeO2+2H2O;
②Be(NO3)2溶液中逐滴加入等浓度的NaOH先后发生反应:Be(NO3)2+2NaOH=Be(OH)2↓+2NaNO3,Be(OH)2+2NaOH═Na2BeO2+2H2O,先产生沉淀,然后沉淀消失,两次消耗的氢氧化钠的物质的量都为0.02mol(即20mLNaOH溶液),产生的Be(OH)2沉淀为0.01mol,沉淀量随NaOH溶液加人量的变化图为: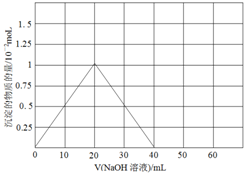 ;
;
故答案为: .
.
点评 本题主要考查了铝的冶炼以及同主族元素性质的相似性和差异性,注意根据题意提取信息是解题的关键,难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸与稀NaOH溶液反应的中和热为57.3 kJ•mol-1 | |
| B. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量为57.3 kJ | |
| C. | 若碳的燃烧热用△H3来表示,则△H3<△H1 | |
| D. | 若碳的燃烧热用△H3来表示,则△H3>△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2NH3→2NaNH2+H2↑ | B. | NH3+HNO3→NH4NO3 | ||
| C. | 4NH3+6NO→5N2+6H2O | D. | 3SiH4+4NH3→Si3N4+12H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 | |
| B. | 明矾和漂白粉常用于自来水的处理,两者的作用原理相同 | |
| C. | 氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,与铜发生置换反应 | |
| D. | 晶体硅具有半导体的性质,所以可以制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 剩余固体是铁、铜混合物 | |
| B. | 反应后溶液中n (Fe2+)+n(Cu2+)=0.75 mol | |
| C. | 反应后溶液中n (Fe3+)=0.10 mol | |
| D. | 原固体混合物中铜的质量是8.0g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com