
(13分)醋酸亚铬水合物([Cr(CH3COO)2)]2·2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸。实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:

Zn(s) + 2HCl(aq) = ZnCl2(aq) + H2(g)
2CrCl3(aq) + Zn(s)= 2CrCl2 (aq) + ZnCl2(aq)
2Cr2+(aq) + 4CH3COO-(aq) + 2H2O(l) = [Cr(CH3COO)2]2·2H2O (s)
请回答下列问题:
(1)检查虚框内装置气密性的方法是 。
(2)醋酸钠溶液应放在装置 中(填写装置编号,下同);盐酸应放在装置 中;
装置4的作用是 。
(3)本实验中所有配制溶液的水需煮沸,其原因是 。
(4)将生成的CrCl2溶液与CH3COONa溶液混合时的操作是 阀门A、 阀门B (填“打开”或“关闭”)。
(5)本实验中锌粒须过量,其原因是 。
(6)为洗涤[Cr(CH3COO)2)]2·2H2O产品,下列方法中最适合的是 。
A.先用盐酸洗,后用冷水洗 B.先用冷水洗,后用乙醇洗
C.先用冷水洗,后用乙醚洗 D.先用乙醇洗涤,后用乙醚洗
(1)将装置连接好,关闭A、B阀门,往装置1中加水,打开活塞后,水开始下滴,一段时间后,如果水不再下滴,表明装置气密性良好。反之,则气密性不好(2分,其它合理答案也给分);
(2)装置3,装置1(各1分);可以防止空气进入装置3(1分,其它合理答案也给分)。
(3)去除水中的溶解氧,防止Cr2+被氧化 (2分)
(4)打开;关闭 (各1分)
(5)产生足够的H2;与CrCl3充分反应得到CrCl2 (2分)
(6)C (2分)
【解析】
试题分析:(1)可利用装置内外压强差来验证装置的气密性:将装置连接好,关闭A、B阀门,往装置1中加水,打开活塞后,水开始下滴,一段时间后,如果水不再下滴,表明装置气密性良好。反之,则气密性不好;(2)整套装置的工作原理是:先在装置2中制备出二价的铬离子,在制备过程中,因为二价铬离子容易被空气中的氧气氧化成三价。因此在装置2中,我们要放入足够多的锌粒,一是还原三价铬,二是用来产生氢气排除装置内的空气。反应开始前,应该先打开B让氢气充满整个装置,然后再关闭B,打开A,让装置2中的二价铬离子进入装置3,跟醋酸钠反应生成醋酸亚铬水合物。因此,醋酸钠溶液应放在装置3中,盐酸应放在装置1中;装置4的作用是:可以防止空气进入装置3。(3)本实验中所有配制溶液的水需煮沸,其原因是:去除水中的溶解氧,防止Cr2+被氧化(4)将生成的CrCl2溶液与CH3COONa溶液混合时的操作是打开阀门A、关闭阀门B;这样装置2中的溶液就可以在氢气的压力下,将液体压往装置3中进行反应。(5)本实验中锌粒须过量,其原因是:①产生足够的H2;②与CrCl3充分反应得到CrCl2 。(6)洗涤[Cr(CH3COO)2)]2·2H2O产品,主要是洗去附着在表面的没有反应掉的二价铬离子、氯离子、醋酸根离子、钠离子等,不能用乙醇和盐酸,因为醋酸亚铬水合物,是微溶于醇,易溶于盐酸。因此先用水洗去杂质离子,再用乙醚来洗去多余的水。多余的乙醚可以挥发掉,选C 。
考点:考查物质的制备、分离和提纯。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014重庆市主城七区高三下学期第二次联考理综化学试卷(解析版) 题型:简答题
(14分)近年来雾霾天气多次肆虐我国部分地区。其中燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)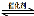 2CO2(g)+ N2(g) 。在密闭容器
2CO2(g)+ N2(g) 。在密闭容器
中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
①该反应的△H 0(填“<”或“>”)。
②在T2温度下,0~2s内的平均反应速率v (N2)为 。
③若该反应在绝热、恒容的密闭体系中进行,下列图2中正确且能说明反应在进行到t1时刻达到平衡状态的是 (填字母编号)。
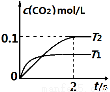
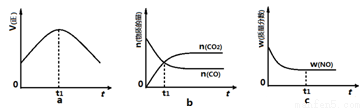
图1 图2
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g) N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐
水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
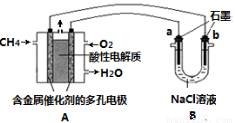
①该燃料电池的负极反应式为 。
②电解后溶液的pH约为 (忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下约为 L。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高二下学期期末考试化学试卷(解析版) 题型:选择题
主链上有6个碳原子,有一个甲基和一个乙基作为支链的烷烃有
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
(原创)用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,46g NO2中含有的分子数为NA
B.通常状况下,14g CO含有的电子数目为7NA
C.1L 0.2 mol/L的CH3COOH溶液中,H+ 数目为0.2NA
D.0.1mol Cu 和与40mL 10mol/L硝酸反应后,溶液中的NO3-数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
已知X(g)+3Y(g)═ 2Z(g)△H>0,下列对该反应的说法中正确的是
A.△S>0
B.逆向能自发进行,且反应速率和平衡常数均较大
C.反应物总能量大于生成物总能量
D.在任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
将一定量Fe和Fe2O3混合物放入2 mol·L-1的HNO3溶液25mL中,反应完成后,无固体剩余,生成224mLNO气体(标准状况),再向反应后的溶液中加入1 mol·L-1的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是
A.45mL B.50mL C.40mL D.无法确定
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
用高铁酸钠(Na2FeO4)对河水、湖水消毒,是城市饮用水消毒的新技术。已知制备高铁酸钠的反应为Fe2O3+3Na2O2=2Na2FeO4+Na2O,下列说法正确的是
A.Na2O2 既是氧化剂,又是还原剂
B.Fe2O3在反应中得到电子
C.3 mol Na2O2参加反应,转移的电子总数为12mol
D.Na2FeO4能消毒杀菌,因其具有强氧化性
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:选择题
铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如图所示。下列说法正确的是
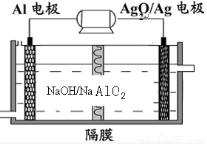
A.电池负极反应式2Ag+2OH--2e-= Ag 2O+H2O
B.放电时电池负极附近PH减小
C.电池总反应式2Al+3Ag2O+6H+ =2Al3++6Ag+3H2O
D.电解液中Na+通过隔膜由右向左移动
查看答案和解析>>
科目:高中化学 来源:2013-2014福建龙岩市毕业联合考试理综化学试卷(解析版) 题型:选择题
在K2CrO4的溶液中存在着如下的平衡:2CrO42- + 2H+ Cr2O72- + H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
Cr2O72- + H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
A.>7 B.<7 C.=7 D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com