
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。
回答下列问题:
⑴乙中反应的离子方程式为 ;
⑵乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是 (填字母)
a.饱和食盐水 b.饱和NaHCO3溶液 c.浓NaOH溶液 d.浓硫酸
⑶丁在实验中的作用是 ;装有碱石灰的干燥管的作用是 ;
⑷戊中盛有含Ca(OH)20.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 ;请说明该测得值与实际处理的百分率相比偏高还是偏低 ?简要说明可能的原因 ;
⑸请提出一个能提高准确度的建议(要有可操作性,不宜使操作变得过于复杂) 。
(1)2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O(1分) 20081226
(2)a (1分)(3)去除Cl2(1分)防止空气中CO2进入戊中影响测定准确度 (1分)
解析试题分析:根据题给信息知,处理有氰电镀的废水时发生的反应为:CN-+ClO-=CNO-+Cl-;2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O;实验的目的是通过测定反应生成二氧化碳的量来确定对CN-的处理效果,必须除去CO2中的HCl和Cl2等,还要防止空气中的二氧化碳进入装置,以提高二氧化碳测定的准确性,可用饱和食盐水来除氯化氢,用灼热的铜来除氯气,最后可用碱石灰防止空气中的二氧化碳进入装置;⑴乙中反应的离子方程式为2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O;⑵a.饱和食盐水可以除去混合气中氯化氢,正确; b.饱和NaHCO3溶液虽能除去氯化氢但会产生二氧化碳,错误; c.浓NaOH溶液会吸收二氧化碳,错误; d.浓硫酸不能吸收氯化氢,错误;选a.。⑶丁在实验中的作用是去除Cl2;装有碱石灰的干燥管的作用是防止空气中CO2进入戊中影响测定准确度;(4)根据题给反应的关系式:CN-——CaCO3,则被处理的CN-的物质的量等于CaCO3的物质的量,为0.0082mol,原混合液中CN-的物质的量为:0.2L×0.05mol·L-1=0.001mol,该实验中测得CN-被处理的百分率等于82%;该测得值与实际处理的百分率相比偏低,原因是装置乙、丙、丁中可能滞留有CO2 ,CO2产生的速度较快未与戊中的澄清石灰水充分反应;⑸能提高准确度的建议见答案。
考点:以工业废水中CN-含量的测定为载体,考查离子方程式的书写、物质的分离提纯及实验方案的设计与评价。


科目:高中化学 来源: 题型:实验题
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: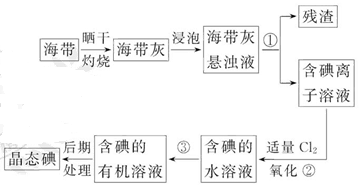
(1)步骤①的实验操作名称是_________;
(2)现有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品。完成该实验尚缺少的玻璃仪器是_________;
(3)步骤③中能选用CCl4从碘水中萃取碘的原因是_________;
| A.CCl4与水不互溶 |
| B.CCl4可与I2发生取代反应 |
| C.CCl4的密度比水大 |
| D.CCl4不易燃烧,可作灭火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
制备水杨酸对正辛基苯基酯(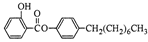 )如下:
)如下:
步骤一:将水杨酸晶体投入三颈烧瓶中,再加入氯苯,搅拌溶解后,加入无水三氯化铝。
步骤二:按图12所示装置装配好仪器,水浴加热控制温度在20~40℃之间,在搅拌下滴加SOCl2,反应制得水杨酰氯,该反应为: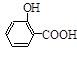 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→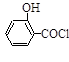 (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑
步骤三:将三颈烧瓶中的混合液升温至80℃,再加入对正辛苯酚[ ],温度控制在100℃左右,不断搅拌。
],温度控制在100℃左右,不断搅拌。
步骤四:过滤、蒸馏、减压过滤;酒精洗涤、干燥。
(1)步骤一中加入三氯化铝的作用是 。
(2)实验时,冷凝管中的水应从 进 出(选填“a”或“b”);装置c的作用是 。
(3)步骤三中发生反应的化学方程式为 。
(4)步骤四减压过滤操作中,除烧杯、玻璃棒外,还必须使用的硅酸盐材料的仪器有 。
(5)步骤四减压过滤时,有时滤纸会穿孔,避免滤纸穿孔的措施是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。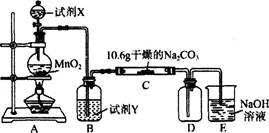
(1)写出装置A中发生反应的离子方程式:
(2)写出试剂Y的名称:_____________________。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设:
假设一:存在两种成分: NaHCO3和__________
假设二:存在三种成分: NaHCO3和__________、___________。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加 足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 | |
| 步骤2:向A试管中滴加______________: | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠。 |
| 步骤3:向B试管中滴加______________: | 若溶液变浑浊,结合步骤2中的①,则假设 一成立:结合步骤2中的②,则假设二成立。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知苯甲酸乙酯的沸点为213℃(在此温度以下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出)。请回答上述实验室制备苯甲酸乙酯的有关问题:
(1)①在三颈烧瓶中加入苯甲酸、浓硫酸、过量的乙醇、沸石;②再向该烧瓶中加入环己烷,装上分水器的回流冷却管。实验中使用分水器的目的是(从化学平衡原理分析)_______________。
(2)缓慢加热回流,至分水器下层液体不再增多,停止加热,放出分水器中液体,分水器中液体的三种主要成分是____________。
(3)将圆底烧瓶中的残液倒入盛有冷水的烧瓶中,用_____________溶液中和至弱碱性分液,分出粗产品;水层用乙醚____________(填实验操作名称),醚层与粗产品合并;用纯水洗有机层两次,将醚层与水尽量分净,醚层从上口倒入一个干燥的锥形瓶。
(4)加入适量豆粒大小的无水氯化钙干燥剂,摇动锥形瓶,至醚层澄清透明;醚层过滤入一个干燥的圆底烧瓶;进行____________(填实验操作名称),先蒸出__________后蒸出苯甲酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学通过如下实验探究反应原理并验证产物。
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
(1)该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2?xMgCO3]
(2)为了确定产物,进行以下定性实验:
| 实验序号 | 实 验 | 实验现象 | 结 论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 安静燃烧, 火焰呈淡蓝色 | 气体成分为 ① |
| 实验Ⅲ | 将实验I中的白色不溶物滤出、洗涤,取少量加入足量 ② | ③ | 白色不溶物中含有MgCO3 |
| 实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适 量 ④ 稀溶液 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32- 离子 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
| | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 2PCl3;2P+5Cl2 2PCl3;2P+5Cl2 2PCl5 2PCl5 |
| PCl3 | —112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
将一定量铁粒放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。
(1)为探究溶液X中铁元素的价态,设计如下实验:
药品和仪器:0.1mol·L-1KSCN溶液、0.1mol·L-1KI溶液、0.2mol·L-1酸性高锰酸钾溶液、氯水、试管和滴管。
请根据实验设计,填写下列实验报告:
| 实验步骤 | 实验操作 | 现象与结论 | 离子方程式 |
| 第1步 | 取2~3mL溶液装于试管,向试管中滴加几滴KSCN溶液 | | |
| 第2步 | | 若溶液紫色褪去,则溶液 含有Fe2+;若无明显变化, 则不含Fe2+ | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)铜陵有色股份有限公司电线电缆厂属国家电线电缆、绕组线行业专业生产厂。在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法。甲同学根据已学知识,提出了一套回收方案:
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu+2H2SO4+O2 2CuSO4+2H2O ) ,于是他提出了另一套方案:
2CuSO4+2H2O ) ,于是他提出了另一套方案:
(1)甲方案的①、③两个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
① ;③ 。
(2)从环保角度对两套方案的不同部分进行比较,你认为 (填“甲”或“乙”)方案更合理,理由是: 。
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑。你认为丙这么说的道理是: 。
丁又提出了疑问:如果铁过量,剩余的铁粉会混在红色粉末中,该怎么处理呢?
请提出你的想法: 。
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益。如果直接排放掉滤液,不仅造成了浪费,还会 。
(5)若上述方案所用的稀硫酸质量分数为36.8%,问每1000mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸 g,需水 mL(水的密度为1.0g/mL ) ,在实验室中稀释浓硫酸时,是如何操作的: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com