
分析 (1)①氨的生成速率与氨的分解速率相等,说明正逆反应速率相等,反应达平衡状态;
②断开1个N≡N键的同时有6个N-H键生成,都体现的正反应的方向;
③N2、H2、NH3的体积分数不再变化,说明各物质的量不变反应达平衡状态;
④气体的总压强不变,说明各物质的量不变,反应达平衡状态;
⑤化学平衡状态时,N2、H2、NH3分子数之比可能为1:3:2,也可能不是,都起始的投料量与转化率有关;
⑥平衡时N2、H2和NH3的浓度不变,而不是相等;
⑦v(N2)=$\frac{1}{3}$v(H2),未体现正与逆的关系;
⑧v正(N2)=$\frac{1}{3}$v正(H2)=$\frac{1}{3}$v逆(H2),所以正逆反应速率相等,反应达平衡状态;
⑨混合物的密度一直不变;
⑩混合物的平均相对分子质量不变,说明气体的物质的量不变,反应达平衡状态;
(2)起始时充入的N2和 H2 的物质的量分别是3.0mol和6.0mol,平2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,则
N2+3H2 ?2NH3
开始:3.0 6.0 0
转化:a 3a 2a
平衡:3.0-a 6-3a 2a
则:6-3a=2a,所以a=1.2mol,由此分析解答:(2)、(3)、(4)、(5).
解答 解:(1)①氨的生成速率与氨的分解速率相等,说明正逆反应速率相等,反应达平衡状态,故正确;
②断开1个N≡N键的同时有6个N-H键生成,都体现的正反应的方向,故错误;
③N2、H2、NH3的体积分数不再变化,说明各物质的量不变反应达平衡状态,故正确;
④气体的总压强不变,说明各物质的量不变,反应达平衡状态,故正确;
⑤化学平衡状态时,N2、H2、NH3分子数之比可能为1:3:2,也可能不是,都起始的投料量与转化率有关,故错误;
⑥平衡时N2、H2和NH3的浓度不变,而不是相等,故错误;
⑦v(N2)=$\frac{1}{3}$v(H2),未体现正与逆的关系,故错误;
⑧v正(N2)=$\frac{1}{3}$v正(H2)=$\frac{1}{3}$v逆(H2),所以正逆反应速率相等,反应达平衡状态,故正确;
⑨混合物的密度一直不变,故错误;
⑩混合物的平均相对分子质量不变,说明气体的物质的量不变,反应达平衡状态,故正确;
故选:B;
(2)起始时充入的N2和 H2 的物质的量分别是3.0mol和6.0mol,平2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,则
N2+3H2 ?2NH3
开始:3.0 6.0 0
转化:a 3a 2a
平衡:3.0-a 6-3a 2a
则:6-3a=2a,所以a=1.2mol,
从反应开始到达到平衡用N2表示该反应的速率为:$\frac{\frac{1.2mol}{5.0L}}{2min}$mol•L-1•min-1=0.12mol•L-1•min-1,故答案为:0.12;
(3)平衡时H2的物质的量浓度为$\frac{6-3×1.2}{5}$mol•L-1=0.48 mol•L-1,故答案为:0.48;
(4)H2的转化率是 $\frac{3×1.2}{6}×100%$=60%,故答案为:60%;
(5)平衡时混合气体中NH3的体积分数是 $\frac{2×1.2}{3+6-2×1.2}×100%$=36.4%,故答案为:36.4.
点评 本题考查化学平衡的计算,明确化学平衡三段法计算格式及转化率、体积分数的计算方法即可解答,注意格式规范,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4与Cl2反应生成的四种有机产物常温下都是液体 | |
| B. | CH4、CCl4都是正四面体结构 | |
| C. | CH4是天然气、沼气、水煤气、坑道气的主要成分 | |
| D. | CH4通常情况下性质稳定,但可以和氯水在光照条件下发生反应 |
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:推断题
【选做题——有机化学基础】
四苯基乙烯(TPE)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广阔。以下是TPE的两条合成路线(部分试剂和反应条件省略):

(1)A的名称是________;试剂Y为____________。
(2)B→C、F→D的反应类型依次是_____________、_____________;B中官能团的名称是________,D中官能团的名称是____________。
(3)已知E的化学式为C13H11Br,E→F的化学方程式是_________________。F→D的化学方程式是________________________。
(4)W是D的同分异构体,具有下列结构特征:①属于萘( )的一元取代物;②存在羟甲基( -CH2OH)。写出W所有可能的结构简式:______________________。
)的一元取代物;②存在羟甲基( -CH2OH)。写出W所有可能的结构简式:______________________。
(5)下列说法正确的是___________。
a.B的酸性比苯酚强 b.D不能发生还原反应
c.E含有3种不同化学环境的氢 d.TPE既属于芳香烃也属于烯烃
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:选择题
a mol FeS和b mol Fe3O4投入到VL c mol/L的硝酸溶液中恰好完全反应,假设只产生标准状况2.24 L NO气体,溶液中只有Fe(NO3)3和H2SO4的混合液,向溶液中逐渐滴入c′ mol/L NaOH溶液,则当沉淀达最大时,消耗NaOH溶液的体积是
A. L B.
L B. L C.
L C. D .
D . L
L
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:实验题
利用废铅蓄电池的铅泥(PbO、Pb及PbSO4等)可制备精细无机化工产品﹣3PbO•PbSO4•H2O (三盐),主要制备流程如下:

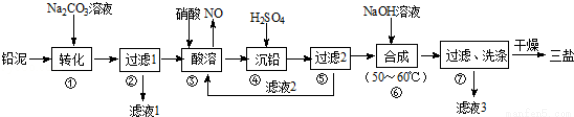
(1)步骤①PbSO4转化为难溶PbCO3的离子方程式为______________.
(2)滤液1和滤液3经脱色、蒸发、结晶可得到的副产品为______________(写化学式).
(3)步骤③酸溶时,其中的铅与硝酸生成Pb(NO3)2及NO的离子方程式为______________;滤液2中溶质主要成分为______________(写化学式).
(4)步骤⑥合成三盐的化学方程式为______________.
(5)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是______________.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ca2+的结构示意图为 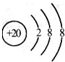 | |
| B. | 氯仿的化学式:CHCl3 | |
| C. | R2+离子核外有a 个电子,b 个中子,R 原子表示为:a+ba+b+2R | |
| D. | 溴化氢分子的电子式: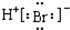 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com