


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
 核磁共振氢谱有
核磁共振氢谱有查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①不变浑浊,②变浑浊 |
| B、①变浑浊,②不变浑浊 |
| C、①和②都变浑浊 |
| D、①和②始终都未见沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液中:Ca2+、H+、Cl-、HSO3- |
| B、能使PH试纸呈红色的溶液:Na+、NH4+、Fe2+、NO3- |
| C、Na2CO3溶液:K+、Fe3+、SO42-、NO3- |
| D、Kw/c(H+)=0.1mol/L的溶液:Na+、K+、S2-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入H2O2的主要作用是将溶液中的Fe2+氧化为Fe3+ |
| B、CuSO4?5H2O和Al2(SO4)3?18H2O均属于混合物 |
| C、实验室中过滤时可直接将滤液倒入有滤纸的漏斗中 |
| D、高锰酸钾溶液也可以氧化Fe2+,所以第②步中可以用酸性高锰酸钾溶液代替H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
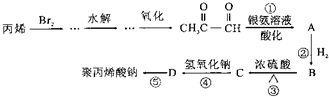
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨是人类科学技术发展史上的一项重大突破,解决了地球上因粮食不足而导致的饥饿与死亡.
合成氨是人类科学技术发展史上的一项重大突破,解决了地球上因粮食不足而导致的饥饿与死亡.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com