
| A. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 | |
| B. | 饮食“镉大米”会影响骨骼和肾脏,镉元素属于重金属元素 | |
| C. | 使用增塑剂--邻苯二甲酸酯可使聚氯乙烯由弹性塑胶变为硬塑胶 | |
| D. | 面粉生产中禁止添加的过氧化钙(CaO2)中阴阳离子的个数比为1:2 |
分析 A.二氧化硫可用作葡萄酒的抗氧化剂;
B.镉属于重金属;
C.增塑剂(又叫塑化剂)是一种增加塑料柔韧性、弹性等的添加剂;
D.过氧化钙构成离子是钠离子和过氧根离子.
解答 解:A.二氧化硫具有较强的还原性,故常用作葡萄酒的抗氧化剂,故A错误;
B.镉属于重金属,能使蛋白质变性,有毒,故B正确;
C.邻苯二甲酸酯不能使聚氯乙烯由弹性塑胶变为硬塑胶,故C错误;
D.过氧化钙构成离子是钠离子和过氧根离子,CaO2中阴阳离子的个数比为1:1,故D错误.
故选B.
点评 本题考查化学与生产、生活的关系,题目难度不大,要求学生能够用化学知识解释化学现象,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸常温下可与铜片迅速反应生成二氧化硫气体 | |
| C. | 浓硫酸是一种常用的干燥剂,可用来干燥氢气、氨气等 | |
| D. | 浓硫酸具有强氧化性,常温时可使铁、铝钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 塑料、橡胶、合成纤维、酚醛树脂都属于有机高分子化合物 | |
| B. | 鸡蛋清中加入Na2SO4、CuSO4都会因盐析产生沉淀 | |
| C. | 油脂的皂化反应生成高级脂肪酸和丙醇 | |
| D. | 通过石油催化重整是获得烯烃的主要途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C |
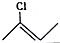 |  |  |
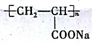 .
.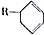 结构,D可能的结构有4种;写出
结构,D可能的结构有4种;写出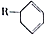 和Cl2发生1,4-加成反应的化学方程式:
和Cl2发生1,4-加成反应的化学方程式: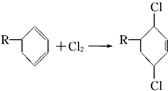 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A.B,C,D,E五种元素,均位于元素周期表的前四周期.它们的核电荷数逐渐增加.且核电荷数之和为57;B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同.E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.请回答下列问题:
A.B,C,D,E五种元素,均位于元素周期表的前四周期.它们的核电荷数逐渐增加.且核电荷数之和为57;B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同.E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.请回答下列问题: ,Y中D原子的杂化轨道类型为sp3杂化;C与A形成的常见化合物的分子构型为三角锥形.
,Y中D原子的杂化轨道类型为sp3杂化;C与A形成的常见化合物的分子构型为三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
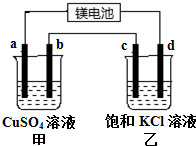 用一种镁二次电池(反应为:xMg+Mo3S4$?_{充电}^{放电}$MgxMo3S4)连接甲、乙装置进行电解.如图所示,a、b、c均为石墨电极,d为Fe电极,电解时d极有气体放出.下列说法不正确的是( )
用一种镁二次电池(反应为:xMg+Mo3S4$?_{充电}^{放电}$MgxMo3S4)连接甲、乙装置进行电解.如图所示,a、b、c均为石墨电极,d为Fe电极,电解时d极有气体放出.下列说法不正确的是( )| A. | 甲装置中a的电极反应为4OH--4e-═O2↑+2H2O | |
| B. | 放电时镁电池正极的电极反应为 Mo3S4+2xe-═Mo3S42x- | |
| C. | 当d极产生0.56 L(标准状况)气体时,b极增重3.2 g | |
| D. | 镁电池放电时,甲池中的SO42-移向a电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
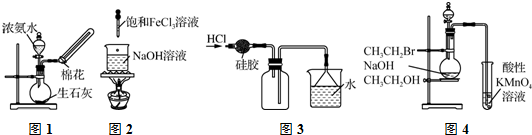
| A. | 利用图1所示装置制取少量NH3 | |
| B. | 利用图2所示装置制备Fe(OH)3胶体 | |
| C. | 利用图3所示装置收集HCl | |
| D. | 利用图4所示装置检验是否生成乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com