
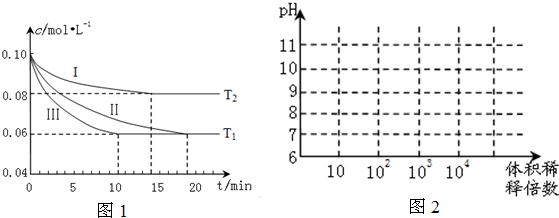
| △c |
| △t |
 NH3?H2O(aq)+H+(aq)的关系,可求NH3?H2O的电离平衡常数;
NH3?H2O(aq)+H+(aq)的关系,可求NH3?H2O的电离平衡常数;| △c (N2) |
| △t |
| (0.10-0.06 )mol?L-1 |
| 10min |
| △c (N2) |
| △t |
| (0.10-0.06 )mol?L-1 |
| 10min |
 NH4+(aq)+OH-(aq)可以看作H2O
NH4+(aq)+OH-(aq)可以看作H2O H+(aq)+OH-(aq)减去反应NH4+(aq)+H2O(l)
H+(aq)+OH-(aq)减去反应NH4+(aq)+H2O(l) NH3?H2O(aq)+H+(aq),则NH3?H2O的电离平衡常数K=
NH3?H2O(aq)+H+(aq),则NH3?H2O的电离平衡常数K=| Kw |
| 5.55×10-10mol?L-1 |
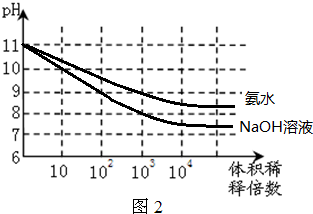
 ;
;

科目:高中化学 来源: 题型:
| A、0.1mol?L-1 Na2S溶液中含有的Na+离子数为0.2NA |
| B、50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| C、标准状况下,22.4L以任意比例混合的氢气和氯气混合气中含有的原子总数为2NA |
| D、0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去Cu2+(aq)中混有的少量Fe3+,可向其中通入过量的NH3 |
| B、在中和热测定的实验中,做三次平行实验最少要使用6次温度计 |
| C、FeCl3溶液与KSCN溶液混合,存在下述平衡:FeCl3+3KSCN?Fe(SCN)3+3KCl当达到平衡时,保持其他条件不变,可向其中加入固体KCl,来探究浓度对反应速率的影响 |
| D、常温下,用pH计测量等物质的量浓度的NaHC03和NaHS03溶液的pH,来探究H2CO3、H2SO3酸性的相对强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
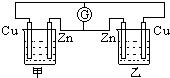 在如图的装置中,甲、乙两烧杯中都盛有相同体积的0.1mol/L的硫酸溶液,下列有关实验的叙述中,错误的是( )
在如图的装置中,甲、乙两烧杯中都盛有相同体积的0.1mol/L的硫酸溶液,下列有关实验的叙述中,错误的是( )| A、电流计G的指针不动 |
| B、通过电流计G的电子流动方向是由下向上 |
| C、甲、乙两装置都不是电解槽 |
| D、甲装置中铜极上有气泡产生,乙装置中,[H+]会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 物理量 | V[0.1mol?L-1 Fe2(SO4)3]/mL | … | |
| 1 | a | … | |
| 2 | a | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 40 |
| 2 |
| 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 运用化学反应原理研究部分单质及其化合物的反应有重要意义.
运用化学反应原理研究部分单质及其化合物的反应有重要意义.| 1 |
| 2 |
c(C
| ||
c(S
|
查看答案和解析>>
科目:高中化学 来源: 题型:
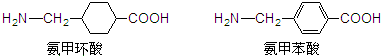
| A、氨甲环酸、氨甲苯酸都既能溶于盐酸,又能溶于NaOH溶液 |
| B、氨甲苯酸属于芳香族α-氨基酸的同分异构体和苯丙氨酸互为同系物 |
| C、氨甲环酸、氨甲苯酸都能发生取代、氧化、缩聚、加成等反应 |
| D、氨甲环酸、氨甲苯酸中各有5种不同的氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将硫的酒精溶液滴入一定量的热水中得微蓝色透明液体,用激光笔照射 | 有丁达尔效应 | 微蓝色液体为胶体 |
| B | 将FeSO4高温强热,得红色固体,产生的气体通入BaCl2溶液 | 产生白色沉淀 | 白色沉淀为BaSO4和BaSO3 |
| C | 将气体X分别通入品红溶液和酸性高锰酸钾溶液 | 两溶液均褪色 | X可能是乙烯 |
| D | 向溶液Y中滴加硝酸,再滴加BaCl2溶液 | 有白色沉淀生成 | Y中一定含有SO42- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com