
草酸二酯(CPPO)结构简式如右图,下列说法正确的是( )
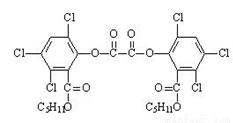
A.草酸二酯的分子式为C26H22Cl6O8
B.1mol草酸二酯与氢氧化钠稀溶液反应时(苯环上卤素不水解),最多消耗6mol NaOH
C.草酸二酯酸性条件下水解可以得到两种有机物
D.1mol草酸二酯与氢气完全反应,需要氢气10mol
科目:高中化学 来源:2016届湖北省沙市高三下高考第一次模拟理综化学试卷(解析版) 题型:选择题
苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g)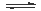 C6H5CH=CH2(g)+H2 (g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),右图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系。下列说法正确的是
C6H5CH=CH2(g)+H2 (g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),右图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系。下列说法正确的是

A.a、b两点转化率不等,但是化学平衡常数相等
B.b点转化率为50%,则混合气体中苯乙烯的体积分数为1/3
C.恒容时加入稀释剂(水蒸气)能减小C6H5C2H5平衡转化率
D.b点和c点温度和压强相同,故其反应速率也相等
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高一下期中化学试卷(解析版) 题型:选择题
白磷结构如图所示,与O2反应生成P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有共价键的数目是( )
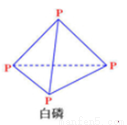
A.10 B.24 C.12 D.28
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高一下期中化学试卷(解析版) 题型:选择题
下列关于化学键的说法中正确的是( )
A.构成单质分子的微粒中一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子里的化学键一定都是极性键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高二下期中化学试卷(解析版) 题型:实验题
(1)欲从苯酚的乙醇溶液中回收苯酚,有下列操作,合理的顺序是 (填字母)。
①蒸馏 ②过滤 ③静置分液 ④加入足量金属钠 ⑤通入过量CO2
⑥加入足量NaOH 溶液 ⑦加入足量FeCl3溶液 ⑧加入足量浓溴水
A. ⑧ ② B.⑥ ① ⑤ ③ C.④② D.⑦ ① ③
(2)下列说法正确的是 (填序号)。
①麦芽糖及其水解产物均能发生银镜反应,且试管内壁的银镜需用稀氨水洗涤
②蛋白质溶液中加入饱和硫酸铵溶液,有沉淀析出,加水后沉淀也不溶解
③淀粉液中加入几滴稀硫酸加热几分钟,冷却后加入银氨溶液并水浴加热,没有观察到银镜现象,证明淀粉未发生水解
④只用溴水就能鉴别四氯化碳、甲苯、乙烯、乙醇
Ⅱ已知:CH3CH2OH+NaBr+H2SO4(浓)  CH3CH2Br+NaHSO4 +H2O。
CH3CH2Br+NaHSO4 +H2O。
实验室制备溴乙烷(沸点为38.4℃)的装置如图:圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的10.3g溴化钠和几粒碎瓷片,小火加热,使NaBr充分反应。
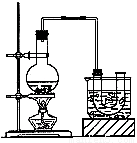
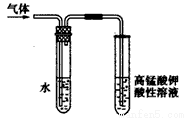
(1)反应时若温度过高会降低溴乙烷的产率,原因是 ;也可看到有红棕色气体产生,该气体的化学式为 。为避免温度过高,宜采用 加热。
(2)反应结束后,U形管中粗制的溴乙烷呈棕黄色。为了除去其中的杂质,最好选用下列试剂中的
(填序号)。
A.Na2SO3溶液 B.H2O C.NaOH溶液 D.CCl4
(3)溴乙烷在NaOH水溶液和NaOH乙醇溶液发生不同类型的反应,生成不同的产物,用右图所示装置进行实验:该实验的目的是 。 盛水的试管(装置)的作用是 。
(4)为检验溴乙烷中的溴元素,正确的操作顺序是:取少量溴乙烷,然后 (填序号)。
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却
(5)经提纯最终得到纯净的溴乙烷为7.63g,则溴乙烷的产率为 (保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高二下期中化学试卷(解析版) 题型:选择题
相对分子质量为100的有机物A能与Na反应,且完全燃烧只生成CO2和H2O,若A含一个六碳环,则环上的一氯代物的数目为( )
A.5 B.4 C.3 D.2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高二下期中化学试卷(解析版) 题型:选择题
下列物质能发生消去反应生成相应的烯烃,不能氧化生成相应醛的是 ( )
A.CH3OH B. CH3CH2CH2OH C.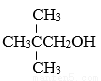 D. CH3CHOHCH3
D. CH3CHOHCH3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南衡阳一中高一下期中化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
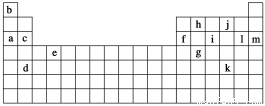
(1)下列______(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
a.原子核对核外电子的吸引力 b.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
锂 | X | Y | |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7 296 | 4 570 | 1 820 |
失去第三个电子 | 11 799 | 6 920 | 2 750 |
失去第四个电子 | 9 550 | 11 600 |
①通过上述信息和表中的数据分析,为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量?__________________________________________。
②表中X可能为以上13种元素中的________(填写字母)元素。用元素符号表示X和j形成化合物的化学式_________。
③Y是周期表中的______族元素。
④以上13种元素中,______(填写字母)元素原子失去核外第一个电子所需要的能量最多。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:选择题
实验室用铅蓄电池作电源电解饱和食盐水制取Cl2,已知铅蓄电池放电时发生如下反应:负极:Pb+SO-2e-===PbSO4 正极:PbO2+4H++SO+2e-===PbSO4+2H2O今欲制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
A.0.025 mol B.0.050 mol C.0.100 mol D.0.20 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com