
分析 ①17.6g丙烷物质的量为0.4mol,每摩尔丙烷中含有共价键10mol;
②C3H6和C4H8的最简式为CH2,根据最简式计算出混合物中含有的碳原子数;
③不一定是在标准状况下;
④依据n=$\frac{m}{M}$计算物质的量,再计算微粒数;
⑤氢氧化钠电离出氢氧根离子,抑制水的电离;
⑥胶体微粒是氢氧化铁的集合体.
解答 解:①17.6g丙烷物质的量为$\frac{17.6g}{44g/mol}$=0.4mol,每摩尔丙烷中含有共价键10mol,所以0,4mol丙烷含共价键为0.4mol×10=4mol,即4NA,故①正确;
②常温下,21g C3H6和C4H8的混合物中含有最简式CH2的物质的量为$\frac{21g}{14g/mol}$=1.5mol,故含有的碳原子数为1.5mol,即1.5NA,故②正确;
③不一定在标准状况下,2.24L H2不一定是0.1mol,故③错误;
④依据2gD216O的物质的量=$\frac{2g}{20g/mol}$=0.1mol,故所含有的质子数为0.1mol×10=1mol,即NA个;含有的中子数为0.1mol×10=1mol,即NA个;含有的电子数为0.1mol×10=1mol,即NA个,故④正确;
⑤常温下,pH=13的NaOH溶液中,含有的OH-数目为0.1mol,即0.1NA,氢氧化钠电离出氢氧根离子抑制水的电离,故由水电离的OH-离子数目远小于0.1NA,故⑤错误;
⑥胶体微粒是氢氧化铁的集合体,将100mL0.1mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒小于0.01NA.故⑥错误;
故说法中正确的是:①②④.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 有些活泼金属,如铝可作还原剂法的还原剂 | |
| B. | 用电解NaCl溶液的方法来冶炼金属钠 | |
| C. | 可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
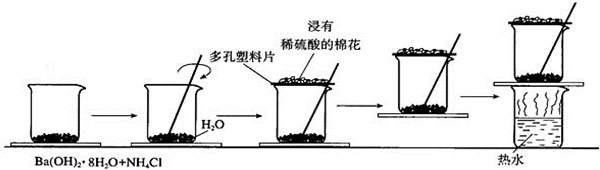
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 的硫酸溶液中NH4+、Fe2+、Cl-、NO3-可以共存 | |
| B. | 向Ba(OH)2 溶液中滴入硫酸溶液的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| C. | 0.1mol•L-1 AlCl3 溶液,温度从20℃升高到50℃,所有离子浓度均增大 | |
| D. | pH=11的NaOH 溶液中有:[OH-]=[Na+]+[H+] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5% | B. | 9.1% | C. | 10.5% | D. | 15% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25mL0.1mol•L-1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体. | 无现象 | 假设一成立 |
| 实验2:在盛有不含O2的25mL0.1mol•L-1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | 生成白色沉淀 |

| 实验步骤、预期现象和结论(不要求写具体操作过程): |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

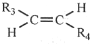 ,则T的结构简式为
,则T的结构简式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com