
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g) CO2(g)+H2(g)某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
CO2(g)+H2(g)某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
| 容器编号 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡的时间/min | 达到平衡时体系能量的变化/kJ | ||
| CO | H2O | CO2 | H2 | ||||
| ① | 650 | 1 | 2 | 0.4 | 0.4 | 5 | 16.4 |
| ② | 650 | 2 | 4 | | | t1 | Q1 |
| ③ | 900 | 2 | 4 | 1.6 | 1.6 | t2 | Q2 |
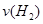 =__________。
=__________。 CO2(g)+H2(g) △H= -41kJ/mol
CO2(g)+H2(g) △H= -41kJ/mol (1)0.17(2)80℅(3)0.04mol/L(4)吸热 升高温度,反应物的转化率增大。(5)a
解析试题分析:(1)化学平衡常数只跟反应温度有关,而与投料方式无关,对于①②化学平衡常数一样。K={C(CO2)·C(H2)}∕{C(CO)·C(H2O)}=(0.2×0.2) ∕{(0. 5-0.2) ×(1-0.2)}=1∕6=0.17.(2)对于容器③达到化学平衡时二氧化碳、氢气的平衡浓度为0.8mol∕L,则消耗的CO、 H2O的浓度也是0.8mol∕L。所以C(CO)(平衡)=(1-0.8)mol∕L=0.2 mol∕L;C(H2O)(平衡)=(2-0.8)mol∕L=1.2 mol∕L。 CO的转化率为:(0.8∕1)×100℅=80℅。(3)容器①中反应达平衡这段时间,化学反应速率V(H2)=ΔC(H2) ∕Δt={(0.4-0) mol∕2L}∕5min=0.04 mol∕(L·min) (4) 容器②假设CO转化浓度为X,K={C(CO2)·C(H2)}∕{C(CO)·C(H2O)}=X2 ∕{(1-X) ×(2-X)} =1∕6.解得X=0.4 mol∕L.所以CO转化率为:(0.4∕1)×100℅=40℅。容器②③只是温度不同,起始投料相同,但CO的转化率前者是40℅,后者是80℅。可见反应物的转化率增大。根据勒夏特列原理可知升高温度化学平衡向吸热方向移动。故正反应是吸热反应。(5) a.容器①和容器②中投料比例相同,反应又是在相同温度下进行,所以反应物的转化率相同,产物的含量即体积分数相同,正确。b.该反应是气体体积相等的可逆反应。改变压强平衡不移动。由于容器②的物质的量是①的2倍,所以能量转化也是①的2倍。即Q1=32.8kJ。容器③与②比较:③温度高升。升高温度化学平衡向正反应方向移动。转化时能量变化比②多。达平衡状态时,Q2>Q1所以反应达平衡状态时,Q2>Q1=32.8kJ。错误。c.在其它条件不变的情况下,增大反应物的浓度,化学反应速率越快;升高温度,化学反应速率越快,达到平衡所需时间就越短。所以达到平衡的时间:t2<t1<2.5min。错误。d.该反应的正反应是吸热反应。所以其热化学方程式应表示为:CO(g)+H2O(g) CO2(g)+H2(g) △H= +41kJ/mol。错误。
CO2(g)+H2(g) △H= +41kJ/mol。错误。
考点:考查可逆反应的化学平衡常数、反应物的转化率、反应速率等问题的知识。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:填空题
工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)  CH3OH(g)+Q
CH3OH(g)+Q
(1)能判断反应达到平衡状态的依据是(填字母序号,下同)________。
| A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
| C.混合气体的平均相对分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示,B中活塞可以自由滑动。A、B中均有1mol X、1mol Y,起始时,V(A)=V(B)=a L。关闭K,相同温度下,两容器中同时发生反应:2X(g)+2Y(g) Z(g)+2W(g) ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8a L。
Z(g)+2W(g) ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8a L。
(1)达到平衡所需的时间:A B。(填“>”、“<”、或“=”,下同)
(2)W的百分含量:A B。
(3)B中X的转化率为 。
(4)打开K,重新达平衡(Ⅱ)时,B的体积为 L(用含a的式子表示,连通管体积忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
设反应①Fe(s)+CO2(g) FeO(s)+CO(g)△H=Q1的平衡常数为K1,
FeO(s)+CO(g)△H=Q1的平衡常数为K1,
反应②Fe(s)+H2O(g) FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
| 温度(T) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
 CO(g)+H2O(g)△H=Q3
CO(g)+H2O(g)△H=Q3查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在温度为298K时,将0.10 mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g) 2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。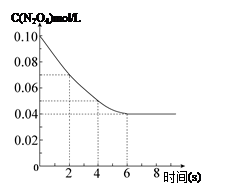
|
| T/K | 310 | 320 |
| K值 | 0.38 | 0.42 |
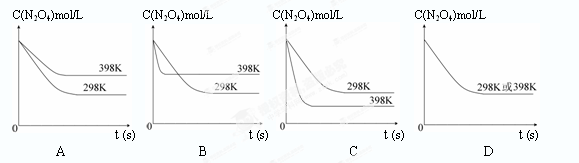
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将等物质的量的A,B混合于2L的密闭容器中,发生反应:3A(g)+B(g) xC(g)+2D(g) ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
xC(g)+2D(g) ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
(l)x的值为_______________;
(2)A的平衡浓度____________;
(3)若恒温恒容,则容器中平衡时的压强与起始时的压强比___________;
(4)下图是某一时间段中该反应速率与反应进程的曲线关系图,回答下列问题: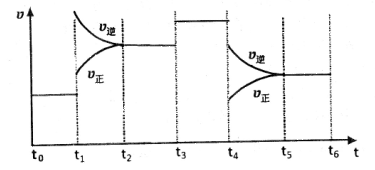
①处于平衡状态的时间段是____________。
② 、
、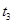 、
、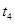 时刻体系中分别是什么条件发生了变化?
时刻体系中分别是什么条件发生了变化? ___________、
___________、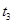 _____________ 、
_____________ 、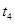 _____________(填A-E)
_____________(填A-E)
A.升温 B.降温 C.加催化剂 D.加压 E.减压
③下列各时间段时,A的体积分数最高的是____
A.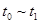 B.
B.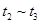 C.
C.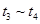 D.
D.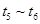
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如右图所示,分析判断: 段化学反应速率最快, 段收集的二氧化碳最多。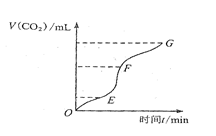
(2)为了减缓上述化学反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
| A.蒸馏水 | B.NaCl固体 | C.NaCl溶液 | D.浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A(g)+B(g) 2 C(g)反应的平衡常数和温度的关系如下:
2 C(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.70 | 1.10 | 1.00 | 0.60 | 0.40 |
 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上高纯硅可以通过下列反应制取:SiCl4(g)+ 2H2(g)  Si (s)+ 4HCl(g) -236kJ
Si (s)+ 4HCl(g) -236kJ
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2L,H2的平均反应速率为0.1mol/(L·min),3min后达到平衡,此时获得固体的质量 g。
(2)该反应的平衡常数表达式K= 。可以通过_______使K增大。
(3)一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是 。
a.2v逆(SiCl4)=v正(H2)
b.断开4molSi-Cl键的同时,生成4molH-Cl键
c.混合气体密度保持不变
d.c(SiCl4):c(H2):c(HCl)=1:2:4
(4)若反应过程如图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第1.5分钟改变的条件是______,第3分钟改变的条件是__________,各平衡态中氢气转化率最小的时间段是_____________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com