
【题目】有BaCl2和NaCl的混合溶液aL,将它均分成两份,一份滴加稀硫酸,使Ba2+完全沉淀,另一份滴加AgNO3,使Cl-完全沉淀,反应中消耗xmol H2SO4、ymol AgNO3。据此得知原溶液中c(Na+)/mol·L -1为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】D
【解析】
由BaCl2和稀硫酸反应可计算Ba2+离子的物质的量,利用NaCl和AgNO3溶液反应计算出Cl-离子的物质的量,由混合液呈电中性可计算出钠离子的物质的量,并注意均分成两份及计算原混合溶液中的c(Na+)来解答即可。
由离子方程式反应Ba2++SO42-=BaSO4↓可知每一等份溶液中的Ba2+离子的物质的量为xmol,根据反应Cl-+Ag+=AgCl↓可知每一等份溶液中Cl-离子的物质的量为ymol, 根据溶液显中性可知:BaCl2和NaCl的混合溶液不显电性,每一份溶液的Na+的物质的量n(Na+)=(y-2x)mol,则原溶液中的钠离子为:n(Na+)总=2(y-2x)mol=(2y-4x)mol,因此原溶液中的钠离子浓度为:c(Na+)=![]() mol/L,故合理选项是D。
mol/L,故合理选项是D。


科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.蛋白质溶液属于胶体,能透过滤纸.
B.在水溶液中或熔融状态下能导电的物质是电解质
C.能电离出氢离子的化合物是酸
D.胶体带电荷,所以会产生电泳现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘油(丙三醇)在纺织、医药、化妆品工业及日常生活中用途很广,可以通过以下方法合成:
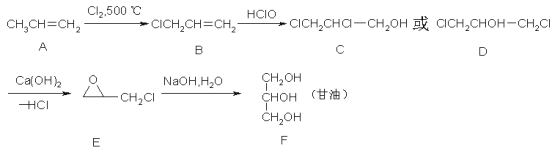
完成下列填空:
(1)A中官能团的名称是____________,A→B的反应类型是__________;
(2)写出A发生加聚反应后产物的结构简式__________________;
(3)B→C的反应类型是______________,C与D互为______________;
(4)写出A→B的化学方程式:__________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)写出CO2和Na2O2反应的化学方程式:___________________________________。
(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?__________,简要说明理由:_______________________________________________。
(3)该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(图中铁架台等装置已略去)。
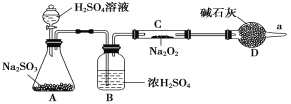
装置中B的作用是_________________,D的作用是_____________________。
(4)将足量的Na2O2投入到含有下列离子的溶液中:NO3-、S2-、HCO3-、CO32-、Na+,设反应完毕后,无固体析出,则上述离子数目减少的有__________,数目增多的离子有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有VL浓度为0.5mol·L-1的盐酸,现欲将此盐酸浓度增大1倍,以下方法最宜采用的是( )
A.加热浓缩到溶液体积为![]() L
L
B.加入10mol/L盐酸0.1VL,再稀释至1.5VL
C.加入0.05mol/L盐酸0.125VL
D.标准状况下通入11.2L氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+物质的量浓度最大的是( )
A. 4 L、0.5 mol·L-1NaCl溶液 B. 1 L、0.3 mol·L-1Na2SO4溶液
C. 5 L、0.4 mol·L-1NaOH溶液 D. 2 L、0.15 mol·L-1、Na3PO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为醋酸K=1.75×10-5,次氯酸K=2.95×10-8,碳酸K1=4.30×10-7 K2=5.61×10-11,亚硫酸K1=1.54×10-2 K2=1.02×10-7。
(1)写出碳酸的第一级电离平衡常数表达式K1=__________。
(2)在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是________。等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序为______________。
(3)若保持温度不变,在醋酸溶液中通入少量HCl,下列量会变小的是________(填字母序号,下同)。
a.c(CH3COO-) b.c(H+) c.醋酸的电离平衡常数
(4)下列离子方程式中错误的是________。
a.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===HCO3-+HClO
b.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
c.过量CO2通入澄清石灰水中:CO2+OH-===HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如图所示:
![]()
下列判断不合理的是( )
A. Al、Ga均处于ⅢA族B. Ga2O3可与盐酸反应生成GaCl3
C. 酸性:Al(OH)3>Ga(OH)3D. Ga(OH)3可与NaOH反应生成NaGaO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在如图所示仪器中,配制上述溶液肯定不需要的是_____(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是____。
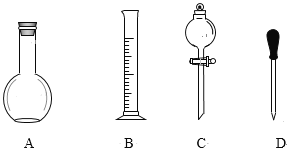
(2)在容量瓶的使用方法中,下列操作不正确的是____(多选题)。
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的NaOH质量为___g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为__mL,如果实验室有10mL、20mL、50mL量筒,应选用___mL量筒最好。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com