
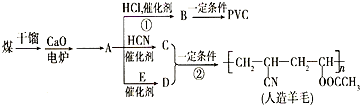
 近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好.如图是以煤为原料生产(PVC)和人造羊毛的合成路线.
近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好.如图是以煤为原料生产(PVC)和人造羊毛的合成路线.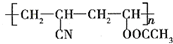 .
.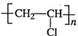 .
.分析 根据合成路线知,A和HCN发生加成反应生成C,A与E反应生成D,C和D反应生成人造羊毛,故D是CH2=CH-OOCCH3,C是H2C=HC-CN,逆推可得A是乙炔、E是CH3COOH.乙炔与氯化氢发生加成反应生成B为氯乙烯,氯乙烯发生加聚反应生成聚氯乙烯PVC为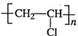 ,据此解答.
,据此解答.
解答 解:根据合成路线知,A和HCN发生加成反应生成C,A与E反应生成D,C和D反应生成人造羊毛,故D是CH2=CH-OOCCH3,C是H2C=HC-CN,逆推可得A是乙炔、E是CH3COOH.乙炔与氯化氢发生加成反应生成B为氯乙烯,氯乙烯发生加聚反应生成聚氯乙烯PVC为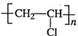 .
.
(1)A→D的化学反应方程式:HC≡CH+CH3COOH$\stackrel{催化剂}{→}$H2C=CH-OOCCH3,
故答案为:HC≡CH+CH3COOH$\stackrel{催化剂}{→}$H2C=CH-OOCCH3;
(2)反应②的化学反应方程式:nH2C=CH-CN+nCH2=CHOOCCH3$\stackrel{一定条件}{→}$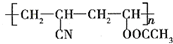 ,
,
故答案为:nH2C=CH-CN+nCH2=CHOOCCH3$\stackrel{一定条件}{→}$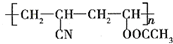 ;
;
(3)PVC的 结构简式为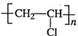 ,故答案为:
,故答案为: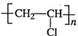 ;
;
(4)D是CH2=CH-OOCCH3,与D互为同分异构体且可发生水解的链状有机物,该物质含有酯基,可能结构有:CH2=CHCOOCH3、CH2=CHCH2OOCH、CH3CH=CHOOCH、CH2=C(CH3)OOCH,
故答案为:4;CH2=CHCOOCH3等.
点评 本题考查有机物的推断,涉及炔、烯等物质的性质、同分异构体的书写、高聚物等,难度中等,根据人造羊毛的结构确定C、D的结构简式是解题关键,注意采用倒推和正推向结合的方法推断


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀.两极材料分别为铁和石墨.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀.两极材料分别为铁和石墨.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
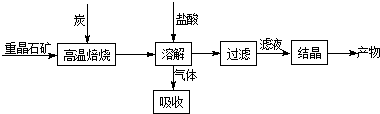
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| E | F | ||||||
| A | C | D | G | R | |||
| B | H |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 3 个 | C. | 2个 | D. | 1个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com