
��7�֣�
����̼����ȼ�ϵ�أ�MCFS����������1889�ꡣ����һ��̼����ȼ�ϵ�أ���һ������Li2CO3��Na2CO3���ڻ����Ϊ����ʣ������¶�Ϊ650�棬�ڴ��¶�������Ϊ��������ú����CO��H2�������Ϊ1��1��ֱ����ȼ�ϣ��乤��ԭ����ͼ��ʾ��
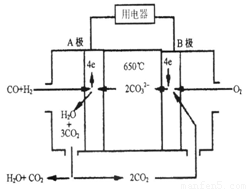
��ش��������⣺
��1��B������____�����������ԭ������Ӧ
��2������ܷ�ӦΪ___________________________________________��
��3���Դ˵�Դ���������CuSO4��Һ��������������0.56 L���ѻ���Ϊ����������������������Ϊ g��������Һ���Ϊ1 L����Һ��pHԼΪ ��
��4������еĵ����̼�����γɵ�ˮ��Һ��ϵ�����ô����������Լ�ƿ���棬��ԭ����
���û�ѧ����ʽ��ʾ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�



�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ���⡱������Ҫ�Ļ���ԭ�ϣ�Ҳ��δ�������������Դ��
���⡱������Ҫ�Ļ���ԭ�ϣ�Ҳ��δ�������������Դ��| ���� |
| c(CH3CH2OH)��C3(H2O) |
| C2(CO2)��C6(H2) |
| c(CH3CH2OH)��C3(H2O) |
| C2(CO2)��C6(H2) |
| n(H2) |
| n(CO2) |
| �¶ȣ�K�� | 500 | 600 | 700 | 800 |
| CO2ת���ʣ�%�� | 60 | 43 | 28 | 15 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2010?������ģ�⣩����̼����ȼ�ϵ���������ڵ�̼����Ϊ����ʵ�ȼ�ϵ�أ��乤��ԭ����ͼ��ʾ��
��2010?������ģ�⣩����̼����ȼ�ϵ���������ڵ�̼����Ϊ����ʵ�ȼ�ϵ�أ��乤��ԭ����ͼ��ʾ��| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 CH3OH��g����CO��ת���ʣ��������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
CH3OH��g����CO��ת���ʣ��������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com