
【题目】中学化学中几种常见物质的转化关系如下图所示

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体.请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围:________.
(2)A、B、H的化学式:A__________、B__________、 H________.
(3)①H2O2分子的电子式为______________。
②写出C的酸性溶液与双氧水反应的离子方程式: _______________________。
(4)写出鉴定E中阳离子的实验方法和现象:_______________________。
(5)在C溶液中加入与C等物质的量的Na 2 O 2 ,恰好使C转化为F,写出该反应的离子方程式:____________________________。
【答案】 1-100nm Fe FeS H2SO4 ![]() 2Fe2++H2O2+2H+=2Fe3+2H2O 取少量E于试管中,用胶头滴管滴加适量的氢氧化钠溶液,加热试管,若生成使湿润的红色石蕊试纸变蓝的气体,则证明铵根离子的存在 4Fe2++4Na2O2+6H2O= 4Fe(OH)3(胶体) +O2↑+8Na+
2Fe2++H2O2+2H+=2Fe3+2H2O 取少量E于试管中,用胶头滴管滴加适量的氢氧化钠溶液,加热试管,若生成使湿润的红色石蕊试纸变蓝的气体,则证明铵根离子的存在 4Fe2++4Na2O2+6H2O= 4Fe(OH)3(胶体) +O2↑+8Na+
【解析】将D溶液滴入沸水中可得到以F为分散质的红褐色胶体,说明F为Fe(OH)3,D溶液中含有Fe3+,D是由B和过量浓硫酸反应生成的,所以D是Fe2(SO4)3,因此E为(NH4)2SO4,C与双氧水反应生成Fe2(SO4)3,所以C为FeSO4,因此A是单质铁,A与硫反应生成FeS,所以B是FeS。在转化关系F+H+A=C中,因F是Fe(OH)3、A是Fe、C是FeSO4,根据元素守恒得H是硫酸。
(1)、红褐色胶体中F是Fe(OH)3,因胶体的粒子直径在1-100nm之间,所以答案是:1-100nm。
(2)根据上述分析可知,A是Fe、B是FeS,H是H2SO4。
(3)、①.双氧水是共价化合物,O与H之间、O与O之间均以共价键相连,所以双氧水的电子式是:![]() 。
。
②.C为FeSO4,与双氧水反应时,C作还原剂,双氧水作氧化剂,其反应的离子方程式是:2Fe2++H2O2+2H+=2Fe3+2H2O。
(4)因E为(NH4)2SO4,常采用与碱共热检验生成的气体是否为氨气来检验铵根离子,所以其检验方法是:取少量E于试管中,用胶头滴管滴加适量的氢氧化钠溶液,加热试管,若生成使湿润的红色石蕊试纸变蓝的气体,则证明铵根离子的存在。
(5)、在C(FeSO4)溶液中加入与C(FeSO4)等物质的量的Na 2 O 2 ,恰好使C(FeSO4)转化为F(Fe(OH)3),根据得失电子守恒和原子守恒规律,其反应的离子方程式是:4Fe2++4Na2O2+6H2O= 4Fe(OH)3(胶体) +O2↑+8Na+。


科目:高中化学 来源: 题型:
【题目】硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2、稀硝酸的还原产物为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)请写出实验室中用Cu与稀HNO3反应制取NO的化学方程式并用双线桥标明电子的转移方向及数目_________________
(2)64gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况下),反应中消耗的HNO3的物质的量是_________(填字母代号)。
A.0.5mol B. 1.0mol C. 2.0mol D. 3.0mol
产生的气体分别是_______________,其物质的量之比是_______________
(3)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等,请将下列3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,并配平该反应的化学方程式。___HNO3+_______→ _______+ _______ +___ NO↑+___H2O
(4)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念--“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是_______(填字母代号)。
A.Cu![]() Cu(NO3)2
Cu(NO3)2
B.Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C.Cu![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2![]() Cu(NO3)2
Cu(NO3)2
D.Cu![]() CuSO4
CuSO4![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列说法 一定正确的是( )

A. 一定存在H+、Mg2+、Al3+、NH4+,一定不存在Na+、SO42﹣、Fe3+
B. 一定存在H+、Al3+、NH4+、SO42﹣,可能存在Na+、Mg2+
C. 溶液中c(H+):c(Al3+):c(Mg2+)为1:1:2
D. 溶液中c(H+)/c(SO42﹣)比值小于等于2/9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种既能提供电能又能固氮的新型氢氮燃料电池的工作原理如图所示,其中电解质溶液为溶有化合物A的稀盐酸。下列有关表述正确的是( )

A. 通入N2的电极发生的电极反应式为N2-6e-+8H+=2NH4+
B. 该装置能将化学能转化为电能,化合物A 为NH4Cl
C. 电子从通入N2的电极流出,经过用电器流向通入H2的电极
D. 反应过程中电解质溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 水电离的c( H+)= 1xl0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42-
B. 能使石蕊呈蓝色的溶液中:Na+、Fe3+、SO42-、Cl-
C. ![]() =lxl0-13 moI/L的溶液中:Ba2+、ClO-、Cl-、NO3-
=lxl0-13 moI/L的溶液中:Ba2+、ClO-、Cl-、NO3-
D. 能与铝反应放出H2的溶液中:K+、Fe2+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多酶片中含有的蛋白酶、淀粉酶、脂肪酶具有辅助消化的作用。下列关于酶的叙述正确的是
A.多酶片中酶的基本组成单位是氨基酸
B.酶的数量因参与化学反应而减少
C.酶提供化学反应开始时所必需的活化能
D.酶在生物体内才起催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面图(1)和图(2)是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图(1)和图(2)两种物质的核磁共振氢谱图选择出可能属于图(1)和图(2)的两种物质 ( )

A. A是C3H8;B是C6H6 B. A是C4H10;B是C6H6
C. A是C3H6;B是C3H6 D. A是C3H6;B是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有SiO32—、OH—、CO32—、SO42—、AlO2—、HCO3—、Na+、Mg2+、Fe3+、Al3+ 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是
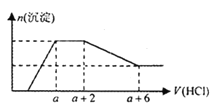
A.原溶液中一定含有Na2SO4
B.反应最后形成的溶液中的溶质只有NaCl
C.原溶液中含有CO32- 与AlO2- 的物质的量之比为1∶2
D.原溶液中一定含有的阴离子是:OH—、CO32—、SiO32—、AlO2—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com