
| A. | 1molCl2与足量Fe反应,转移的电子数为2NA | |
| B. | 标准状况下,22.4LSO3所含的分子数为NA个 | |
| C. | 足量铜与11.18mol/L浓硫酸反应可以得到SO2的分子数总数为9NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去电子数为2NA |
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 远洋海轮的外壳连接锌块可保护轮船不受腐蚀 | |
| B. | 铁制器件在潮湿空气中生锈 | |
| C. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| D. | 金属铝在空气中不易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 陈述 I | 陈述 II | 判断 | |
| A | SO2可使酸性高锰酸钾溶液腿色 | 因为SO2具有漂白性 | I对,II对,有 |
| B | 铁或铝制成的槽车可以密封贮运浓硫酸或浓硝酸 | 因为铁和铝不能与浓硝酸或浓硝酸反应 | I对,II对,无 |
| C | 铝箔在酒精灯火焰上,加热后熔化但液态铝不滴落 | 因为铝在空气中氧化生成一层薄薄的致密氧化膜,熔点高,而金属铝的熔点较低 | I对,II对,有 |
| D | 高压钠灯发出透雾性强的黄光 | 因为金属钠具有强还原性 | I对,II对,有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
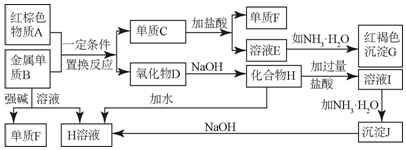
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光伏发电主要利用高纯度单质硅制成的硅太阳能电池 | |
| B. | 硅单既能与氢氧化钠反应又能与氢氟酸反应,所以硅具有两性 | |
| C. | 晶体硅的结构和金刚石类似,是具有金属光泽的灰黑色固体 | |
| D. | 硅太阳能电池可将太阳能直接转化为电能,减少化石燃料的使用,保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 方法 | 结论 |
| A | 实验室制氢气,向稀H2SO4中滴加少量Cu(NO3)2溶液 | 可以加快制备氢气的反应速率 |
| B | 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液, 则溶液变黄 | 氧化性:H2O2>Fe3+ |
| C | 吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行 | 则该反应的△S<0 |
| D | 相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 | 反应速率:粉状大理石>块状大理石 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水可鉴别苯、乙醇、苯乙烯 | |
| B. | 将乙烷和氯气的混合气放在光照条件下反应制备氯乙烷(C2H5Cl) | |
| C. | 苯、溴水、铁粉混合制成溴苯 | |
| D. | 检验氯代烃中含氯,加NaOH溶液加热后,用稀硫酸酸化,再检验 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com