
【题目】一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:
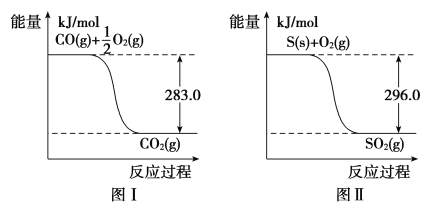
则:(1)① 不用通入O2氧化的方法除去CO的原因是____________________。
②SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
(3)为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示:
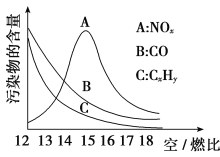
①随空/燃比增大,CO和CxHy的含量减少的原因是_______________________。
②当空/燃比达到15后,NOx减少的原因可能是__________________________。
【答案】(1)① Ni会与氧气反应 ②-270.0 kJ·mol-1
(2)75% 0.045
(3)①空/燃比增大,燃油气燃烧更充分,故CO、CxHy含量减少
②因为反应N2(g)+O2(g) ![]() 2NO(g)是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,使该反应不易进行,故NOx减少
2NO(g)是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,使该反应不易进行,故NOx减少
【解析】(1)①Ni能与氧气反应也会导致其中毒;②由图Ⅰ可知,O2(g)+2CO(g)===2CO2(g) ΔH=(-2×283)kJ·mol-1=-566 kJ·mol-1,(ⅰ),由图Ⅱ可知,S(s)+O2(g)===SO2(g) ΔH=-296 kJ·mol-1,(ⅱ),(ⅰ)-(ⅱ)得:SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=-566-(-296)=-270 kJ·mol-1;(2)设参加反应的CO的浓度为x
CO(g) + H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
![]() 0.30 0.30 0 0
0.30 0.30 0 0
![]() x x x x
x x x x
![]() 0.30-x 0.30-x x x
0.30-x 0.30-x x x
K=9.0=![]() ,x=0.225,
,x=0.225,
所以CO的转化率α(CO)=![]() ×100%=75%,
×100%=75%,
氢气的生成速率v(H2)=![]()
=0.045 mol·L-1·min-1;(3)①空/燃比增大,燃油气燃烧更充分,故CO、CxHy含量减少;②反应N2(g)+O2(g) ![]() 2NO(g)是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低。
2NO(g)是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低。


科目:高中化学 来源: 题型:
【题目】实验室有三瓶失去标签的试剂,分别是Na2CO3、NaCl、AgNO3 ,实验员选择了一种试剂就把它们区别开来了,这种试剂是:
A.氯化钡溶液 B.氢氧化钠溶液 C.盐酸 D.硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应:(1)2Fe3++2I-=2Fe2++I2(2)Br2+2Fe2+=2Br-+2Fe3+,判断各微粒氧化性由强到弱的顺序是( )
A. Br2>I2>Fe3+ B. I2>Fe3+>Br2 C. Br2>Fe3+>I2 D. Fe3+>I2>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,加入1 mol X (g)和2 mol Y(g)发生反应:X(g)+mY(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1∶1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2FeCl3+2KI===2FeCl2+2KCl+I2;②2FeCl2+Cl2=2FeCl3。下列粒子的氧化性从强到弱的顺序正确的是
A. Cl2>Fe3+>I2 B. I2>Cl2>Fe3+ C. Fe3+>Cl2>I2 D. Cl2>I2>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于加成反应的是
A. 乙烯使溴水褪色
B. 甲烷与氯气在光照条件下的反应
C. 苯和液溴在铁作催化剂的条件下反应
D. 乙醇与氧气在铜作催化剂及加热条件下的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l)ΔH1=-19.5kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)ΔH2=-534.2kJ·mol-1
(1)写出肼和N2O4反应生成N2和水蒸气的热化学方程式___________________;
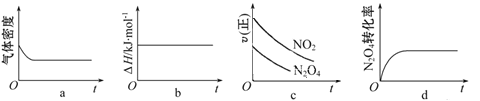
(2)火箭残骸中常现红棕色气体,当温度升高时,气体颜色变深,原因是存在如下反应:N2O4(g)![]() 2NO2(g) ΔH>0,一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生上述反应,下列示意图正确且能说明反应达到平衡状态的是 。
2NO2(g) ΔH>0,一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生上述反应,下列示意图正确且能说明反应达到平衡状态的是 。
(3)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时负极的电极反应式是 。
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com