
���� ��1����֪������ N2��g��+O2��g��?2NO��g����H=+180.5kJ/mol
����2C��s��+O2��g��?2CO��g����H=-221.0kJ/mol
����C��s��+O2��g��?CO2��g����H=-393.5kJ/mol
���ݸ�˹���ɣ�����ʽ��III����2-��I��-��II���õ�����ʽ2NO��g��+2CO��g��?N2��g��+2CO2��g�����ݴ˼��㣻
��2������H-T��S��0����Ӧ���Է����У�
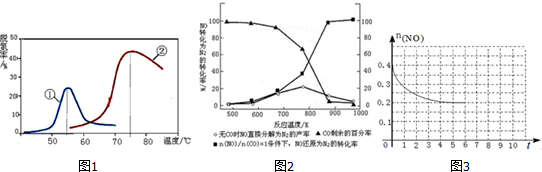
��3��A������ֻӰ�췴Ӧ���ʣ�����ı�ת���ʣ�
B������ѹǿƽ�����淴Ӧ�����ƶ���
C����ߵ�Ϊ����������ߵ��¶ȣ�
D������ͼ���жϣ��Ѱ�����ߵĵ��Ӧ���¶�Ӧ���������¶ȣ�
��4���ٷ���ͼ������߱仯�����жϣ������¶ȣ�����NO�ķֽ��ʽ��ͣ�
�ڸ���ͼ���������¶ȣ�
��5����֪��ӦΪ2NO��g��+2CO��g��?N2��g��+2CO2��g����2L�ܱ������г���NO��CO��0.4mol���ﵽƽ��ʱNOΪ0.2mol����������ʽ���ƽ��Ũ�ȣ��ٸ���K=$\frac{c��{N}_{2}����{c}^{2}��C{O}_{2}��}{{c}^{2}��NO����{c}^{2}��CO��}$���㣻��6���Ӽ�������0.2molNO��0.2molCO��0.2molCO2��0.3molN2������Qc=$\frac{c��{N}_{2}����{c}^{2}��C{O}_{2}��}{{c}^{2}��NO����{c}^{2}��CO��}$���㣬Ȼ��Ƚ�Qc��K�Ĵ�С��ϵ�ж��ƶ���������ͼ��
��6��������������������ԣ�Ҫ��NOx�ѵ�ת��������N2����Ҫ�ӻ�ԭ�����ݴ˷�����
��� �⣺��1����֪������ N2��g��+O2��g��?2NO��g����H=+180.5kJ/mol
����2C��s��+O2��g��?2CO��g����H=-221.0kJ/mol
����C��s��+O2��g��?CO2��g����H=-393.5kJ/mol
���ݸ�˹���ɣ�����ʽ��III����2-��I��-��II���õ�����ʽ2NO��g��+2CO��g��?N2��g��+2CO2��g������H=��-393.5kJ/mol����3-��-221.0kJ/mol��-��+180.5kJ/mol��=-746.5 kJ/mol��
�ʴ�Ϊ��-746.5 kJ/mol��
��2����֪������2NO��g��+2CO��g��?N2��g��+2CO2��g����H=-746.5 kJ/mol���÷�ӦΪ����������ٵķ�Ӧ�����ԡ�S��0����Ҫ��H-T��S��0��T����ֵ�����С�����ڵ���ʱ�Է����У�
�ʴ�Ϊ���������£�
��3��A����������Ӱ��ת���ʣ�ֻӰ�췴Ӧ���ʣ����Եڢ��ִ����͵ڢ��ִ�����ת����û��Ӱ�죬��A����
B����ӦΪ�������ķ�Ӧ������ѹǿƽ�����淴Ӧ�����ƶ����ѵ��ʼ�С����B����
C��ͼ���о����Dz�ͬ�����ڲ�ͬ���¶��µĻ��ԱȽϣ���ߵ�Ϊ������������״̬����ƽ��ת�����أ���C����
D�����ִ����ֱ���55���75�����Ҵ�Ч����ߣ�˵����ʱ�����Ļ������D��ȷ��
��ѡ��D��
��4���������¶ȣ�����NO�ķֽ��ʽ��ͣ�˵����Ӧ���淴Ӧ������У��÷�Ӧ���ȣ���NO�ֽⷴӦ�Ƿ��ȷ�Ӧ�������¶Ȳ����ڷ�Ӧ���У�
�ʴ�Ϊ��NO�ֽⷴӦ�Ƿ��ȷ�Ӧ�������¶Ȳ����ڷ�Ӧ���У�
����ͼ��֪����$\frac{n��NO��}{n��CO��}$=1�������£�870��ʱ��NO��ԭΪN2��ת����Ϊ100%������Ӧ���Ƶ�����¶���870�棻
�ʴ�Ϊ��870�棻
��5����֪��ӦΪ2NO��g��+2CO��g��?N2��g��+2CO2��g����2L�ܱ������г���NO��CO��0.4mol���ﵽƽ��ʱNOΪ0.2mol��
2NO��g��+2CO��g��?N2��g��+2CO2��g��
��ʼ��mol����0.4 0.4 0 0
ת����mol����0.2 0.2 0.1 0.2
ƽ�⣨mol����0.2 0.2 0.1 0.2
��K=$\frac{c��{N}_{2}����{c}^{2}��C{O}_{2}��}{{c}^{2}��NO����{c}^{2}��CO��}$=$\frac{��\frac{0.2}{2}��^{2}����\frac{0.1}{2}��}{��\frac{0.2}{2}��^{2}����\frac{0.2}{2}��^{2}}$=5��
��6���Ӽ�������0.2molNO��0.2molCO��0.2molCO2��0.3molN2����c��NO��=$\frac{0.2mol+0.2mol}{2L}$=0.2mol/L��c��CO��=$\frac{0.2mol+0.2mol}{2L}$=0.2mol/L��
c��N2��=$\frac{0.1mol+0.3mol}{2L}$=0.2mol/L��c��CO2��=$\frac{0.2mol+0.2mol}{2L}$=0.2mol/L��
Qc=$\frac{c��{N}_{2}����{c}^{2}��C{O}_{2}��}{{c}^{2}��NO����{c}^{2}��CO��}$=$\frac{0.2��0��{2}^{2}}{0��{2}^{2}��0��{2}^{2}}$=5=K��˵����ƽ��״̬�����Ե�6���Ӽ�������0.2molNO��0.2molCO��0.2molCO2��0.3molN2������ƽ��״̬������NO�����ʵ�����Ϊԭ����2������ͼΪ ��
��
�ʴ�Ϊ�� ��
��
��6��������������������ԣ�Ҫ��NOx�ѵ�ת��������N2����Ҫ�ӻ�ԭ����NH3��CH4�����ؾ�������ԭ����KMnO4�dz��õ�������������ABD��ȷ��
�ʴ�Ϊ��ABD��
���� ���⿼�黯ѧ��Ӧ�����뻯ѧƽ���ƶ����⣬��ѧƽ�ⳣ����Ӱ�����ء����壬��Ӧ���ʼ���ȣ��Ѷ��еȣ�����ע�����ͼ�����ߵı仯���ƣ������ڿ���ѧ���Ķ�ͼ�����ͷ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������ף�POCl3��������Ϊ��ɫҺ�壬�й㷺Ӧ�ã����������������Ĺ�ҵ���������Ȼ��ġ�����ֱ�������������洫ͳ�����Ȼ��ס��Ȼ�ˮ�ⷨ���������������Ȼ���ˮΪԭ�Ϸ�Ӧ�õ�����
�������ף�POCl3��������Ϊ��ɫҺ�壬�й㷺Ӧ�ã����������������Ĺ�ҵ���������Ȼ��ġ�����ֱ�������������洫ͳ�����Ȼ��ס��Ȼ�ˮ�ⷨ���������������Ȼ���ˮΪԭ�Ϸ�Ӧ�õ����� AgSCN��S��+Cl-��aq�����÷�Ӧʹ�ⶨ���ƫ�ͣ�����ƫ�ߣ�ƫ�ͻ䣩
AgSCN��S��+Cl-��aq�����÷�Ӧʹ�ⶨ���ƫ�ͣ�����ƫ�ߣ�ƫ�ͻ䣩�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 18mol/L��Ũ����15mL L | B�� | 0.2mol/L������12mL | ||
| C�� | 0.15mol/L��������Һ8mL | D�� | 0.1mol/L������15m |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2O | B�� | CH3COOC2H5 | C�� | CH3CH2OH | D�� | CH3COOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��C��s��+O2��g��=CO2��g����H1��CO2��g��+C��s��=2CO��g����H2��2CO��g��+O2��g��=2CO2��g����H3����Ӧ�ȵĹ�ϵ����H1=��H2+��H3 | |
| B�� | ��2H2��g��+O2��g��=2H2O��1����H4��H2��g��+$\frac{1}{2}$O2��g��=H2O��1����H5����Ӧ�ȵĹ�ϵ����H4=��H5 | |
| C�� | ��2SO2��g��+O2��g��=2SO3��g����H��O�������ʵ��ȶ��ԣ�SO2��SO3 | |
| D�� | ������1molH2��g���е�H-H��������1 molO2��g���еĹ��ۼ��ֱ���Ҫ����436 kJ��498 kJ������������H2O��g���е�1 mol H-O���ܷų�463kJ����������2H2��g��+O2��g��=2H2O��g����H=-482kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �÷�Ӧ�Ǹ��ֽⷴӦ | B�� | NO������ԭ��Ӧ | ||
| C�� | CO�������� | D�� | ��Ӧ����O�õ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪��SO2��g��+$\frac{1}{2}$O2��g��?SO3��g����H=-98kJ•mol-1��
��֪��SO2��g��+$\frac{1}{2}$O2��g��?SO3��g����H=-98kJ•mol-1���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com