
| A. | 甲烷 | B. | 乙烷 | C. | 乙醇 | D. | 苯乙烯 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1•min-1 | B. | 0.2 mol•L-1•min-1 | ||
| C. | 0.3 mol•L-1•min-1 | D. | 0.6 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维、棉花、油脂、ABS树脂都是由高分子化合物组成的物质 | |
| B. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| C. | 开发核能、太阳能等新能源,推广基础甲醇汽油,使用无磷洗涤剂都可直接降低碳排放 | |
| D. | 阴极射线、α粒子散射现象及布朗运动的发现都对原子结构模型的建立作出了贡献 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
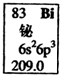
| A. | Bi元素的质量数是209 | |
| B. | Bi原子最外层有5个能量相同的电子 | |
| C. | Bi原子6p亚层有一个未成对电子 | |
| D. | Bi元素的相对原子质量是209.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS2只作还原剂 | |
| B. | 只有CuSO4作氧化剂 | |
| C. | 1 mol CuSO4可以氧化$\frac{5}{7}$ mol硫元素 | |
| D. | 被氧化的硫和被还原的硫的质量之比为3:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2溶液中加入钠的小颗粒 | |
| B. | 饱和的Ca(OH)2溶液中加入钠的小颗粒 | |
| C. | NaOH的饱和溶液中加入钠的小颗粒 | |
| D. | 稀硫酸中加入钠的小颗粒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com